题目内容
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: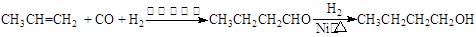
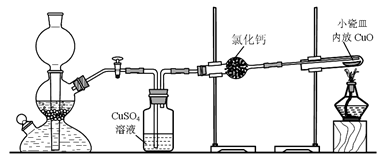
CO的制备原理:HCOOH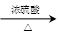 CO↑+H2O,并设计出原料气的制备装置(如下图)
CO↑+H2O,并设计出原料气的制备装置(如下图)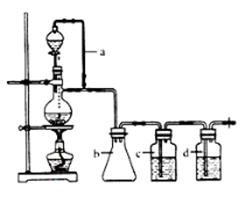
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯。写出制备丙烯的化学方程式: 。
(2)若用以上装置制备干燥纯净的CO,装置中a的作用是 ,装置中b的作用是 ,c中盛装的试剂是 。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是 (填序号)
①饱和Na2SO3溶液;②酸性KMnO4溶液;③石灰水;④无水CuSO4;⑤品红溶液
(4)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R—CHO+NaHSO3(饱和) RCH(OH)SO3Na↓;②沸点:乙醚34℃,
RCH(OH)SO3Na↓;②沸点:乙醚34℃,
1-丁醇118℃,并设计出如下提纯路线: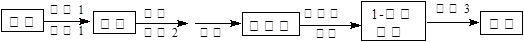
试剂1为 ,操作2为 ,操作3为 。
(1)(CH3)2CHOH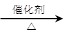 CH2=CHCH3↑+H2O;(2分)
CH2=CHCH3↑+H2O;(2分)
(2)保证分液漏斗内外压强平衡,便于液体顺利流下。(2分)
作为安全瓶,防倒吸 (2分) NaOH溶液 (2分)
(3)④⑤①⑤③②(答④⑤①③②也给分)(2分)
(4)饱和NaHSO3溶液(2分) 萃取(2分) 蒸馏(2分)
解析试题分析:(1)氢气可用活泼金属锌与非氧化性酸盐酸通过置换反应制备,氧化性酸如硝酸和浓硫酸与锌反应不能产生氢气,方程式为Zn+2HCl=ZnCl2+H2↑;2-丙醇通过消去反应即到达丙烯,方程式为:(CH3)2CHOH CH2=CHCH3↑+H2O,故答案为:Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOH
CH2=CHCH3↑+H2O,故答案为:Zn+2HCl=ZnCl2+H2↑;(CH3)2CHOH CH2=CHCH3↑+H2O;
CH2=CHCH3↑+H2O;
(2)甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸.又因为甲酸易溶于水,所以必需防止液体倒流,即b的作用是防止倒吸,最后通过浓硫酸干燥CO.为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;若用以上装置制备氢气,就不再需要加热,所以此时发生装置中的玻璃仪器名称是分液漏斗和蒸馏烧瓶;氢气密度小于空气的,因此要收集干燥的氢气,就只能用向下排空气法,而不能用排水法收集;故答案为:恒压,防倒吸; NaOH溶液,浓H2SO4;分液漏斗、蒸馏烧瓶; ;
;
(3)检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必需考虑试剂的选择和顺序.只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,最后检验CO2和丙烯,因此顺序为④⑤①②③(或④⑤①③②),故答案为:④⑤①②③(或④⑤①③②);
(4)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇.因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开.
故答案为:饱和NaHSO3溶液;过滤;萃取;蒸馏.
考点:本题考查有机物合成方案的设计,题目难度较大,综合性较强,答题时注意把握物质的分离、提纯方法,把握物质的性质的异同是解答该题的关键.

(12分)氯酸钾热分解是实验室制取氧气的一种方法,某探究小组查阅资料得知,氯酸钾在不同条件下分解结果如下:
| 实验 | 反应体系 | 第一放热峰温度(℃) | 第二放热峰温度(℃) |
| l | KC1O3 | 400(无气体放出) | 480(有少量气体放出) |
| 2 | KC1O3+MnO2 | 350(有大量气体放出) | |
 KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。
KCl+2O2↑,请写出在400℃的化学反应方程式 (提示:反应中只有氯元素的化合价改变)。该小组同学利用实验2来制取氧气时,在实验中发现生成的气体略带颜色、并有刺激性气味。
【提出问题】实验中生成的气体中除了氧气外还含有什么物质?
【查阅资料】1.二氧化氯常温下是黄色有强烈刺激性气味的气体
2.二氧化氯具有强氧化性,在溶液中能够把二价锰氧化成四价锰,使之形成不溶于水的二氧化锰(2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl—),而氯气不能。
【提出假设】假设l:含有氯气;假设2:含有二氧化氯。
【设计实验】甲同学设计实验验证假设1成立。
| 实验步骤 | 实验现象 | 实验结论 |
| 将产生的气体接触湿润的淀粉碘化钾试纸 | | 假设l正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| | | 假设2正确 |
某研究小组在实验室中用铜粉(含铁粉5%以上)制取胆矾(CuSO4·5H2O)并检验其纯度,限选试剂:3 mol·L-1H2SO4溶液、浓硝酸、3%H2O2溶液、0.2 mol·L-1NaOH溶液、20% KSCN溶液、BaCl2溶液。有关物质溶解度如下表(单位g/100 g H2O):
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| CuSO4 | 14.3 | 20.7 | 28.5 | 40.0 | 55.0 | 75.4 |
| Cu(NO3)2 | 81.8 | 124.8 | 163.1 | 181.8 | 207.8 | 247.3 |
(1)完成制取胆矾的实验方案。
| 实验步骤 | 预期现象 |
| 步骤1:除铁。将铜粉置于烧杯中,__________________ | _______________________ |
| 步骤2:溶解。将步骤1得到的铜粉置于烧杯中, __________________________ | _______________________ |
| 步骤3:结晶。将步骤2所得溶液蒸发浓缩至液面有晶膜出现,冷却至室温,过滤得粗产品 | |
(2)完成步骤1后,检验铜粉中的铁是否除尽的实验操作是___________。
(3)若胆矾中含有少量Cu(NO3)2·3H2O,测定其中CuSO4·5H2O的含量,实验步骤如下:称量胆矾样品的质量为m1,加水溶解,滴加足量BaCl2溶液,充分反应后过滤,将滤渣烘干、冷却,称得其质量为m2。样品中CuSO4·5H2O的质量分数为________(列出算式)。
下列根据实验操作和现象所得出的结论正确的是( )
| | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
| B | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| C | 在镁、铝为电极,氢氧化钠为电解质的原电池装置中 | 镁表面有气泡 | 金属活动性:Al>Mg |
| D | 向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后加入0.5 mL有机物Y加热 | 未出现砖红色沉淀 | Y中不含有醛基 |