题目内容
【题目】某废液是用稀硝酸腐蚀锌板后得到的 ,某化学兴趣小组拟用该废液(含有少量的 Cl-、Fe3+)制取 Zn(NO3)2·6H2O 的过程如下:
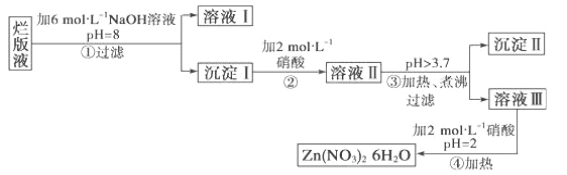
已知:Zn(NO3)2·6H2O 是一种无色晶体,水溶液呈酸性,Zn(NO3)2 能与碱反应,得到的产物 Zn(OH)2 具有
两性,Fe3+在 PH=3.7 时就能完全沉淀。
(1)该废液溶质的主要成分是______(填化学式)。
(2)在操作①中保持 pH=8 的目的是__________________________________________。
(3)沉淀Ⅰ的成分是________________________________________。
(4)操作③中加热、煮沸的目的是______________________________________;
(5)操作④保持 pH=2 的目的是_________________________________________;
【答案】 Zn(NO3)2 防止生成的 Zn(OH)2 沉淀被溶解 Zn(OH)2 和 Fe(OH)3 促进 Fe3+完全水解 抑制 Zn2+水解为 Zn(OH)2
【解析】因为废液是用稀硝酸腐蚀锌板后得到的,所以废液中含有大量的锌离子、氢离子、硝酸根离子和少量的Cl-、Fe3+,加入氢氧化钠调节溶液的pH=8使铁离子、锌离子完全沉淀,然后在沉淀Ⅰ中加硝酸溶解,溶液Ⅱ中含有大量锌离子、氢离子、硝酸根离子和少量的铁离子,调节溶液的pH使铁离子沉淀,溶液Ⅲ是硝酸锌溶液,在酸性条件下加热浓缩蒸发结晶,得到Zn(NO3)2·6H2O是一种无色晶体。(1)废液中溶质的主要成分是Zn(NO3)2;(2)使锌离子完全转化为氢氧化锌,pH不大,如果pH加大氢氧化锌两性又溶解,故答案为:防止生成的Zn(OH)2 沉淀被溶解;(3)Zn2+、Fe3+完全沉淀生成相应的氢氧化物,故沉淀Ⅰ的成分是:Zn(OH)2 和 Fe(OH)3;(4)因为温度越高,水解程度越大,所以加热煮沸促使Fe3+完全水解,故答案为:促进Fe3+完全水解;(5)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,则操作④保持pH=2的目的是抑制Zn2+水解为Zn(OH)2。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案