题目内容
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。
CH3OH(g)。现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图所示。
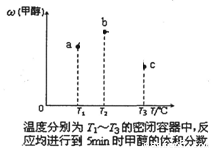
下列说法正确的是
A.该反应的正反应的△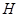 > 0
> 0
B.反应进行到5min时,b容器中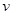 (正)=
(正)=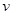 (逆)
(逆)
C.减压可将b中的平衡组成转变成c中的平衡组成
D.达到平衡时,a、b、c中C0的转化率为b>a>c
【答案】
C
【解析】根据图1可知,温度越高,甲醇的含量越低,这说明升高温度平衡向逆反应方向移动,所以正反应是放热反应,A不正确。根据图像可知,从a到b甲醇的量都在上升,是因为T2的温度较高,反应较快最先达到平衡,T1的温度虽然从理论上讲平衡的时候甲醇的量更高,但这个时候温度较T2低,反应慢,还没有达到平衡,实际上产生的甲醇量较少,所以这段温度范围内温度越高反应越快当然产物就越多了;T2之后由于b点的时候已经平衡,所以后面温度更高的也达到平衡了,所以B不正确。减压平衡向逆反应方向移动,生成物的含量降低C正确。由于正反应是放热的可逆反应,所以转化率是a>b>c,选项D不正确。答案选C。

练习册系列答案
相关题目
 (2012?梧州模拟)已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同的温度下进行反应,5min时测得相关数据的关系如图所示.下列说法正确的是( )
(2012?梧州模拟)已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同的温度下进行反应,5min时测得相关数据的关系如图所示.下列说法正确的是( ) 已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)
已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)现在容积均为1L的a、b、c三个密闭容器中分别充入1mol C0和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图1和图2所示.下列说法中不正确的是( )
CH3OH(g)现在容积均为1L的a、b、c三个密闭容器中分别充入1mol C0和2mol H2的混合气体,控制温度,进行反应,测得相关数据的关系如图1和图2所示.下列说法中不正确的是( ) (2011?山西模拟)已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g)
(2011?山西模拟)已知CO和H2在一定条件下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)
CH3OH(g) CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是
CH3OH(g)。现在容积均为1L的a、b、c三个密闭容器中分别充入1mol CO和2mol H2的混合气体,控制在不同温度下进行反应,5min时测得相关数据的关系如图所示。下列说法正确的是