题目内容
【题目】[化学——选修 3:物质结构与性质]
(1) 过渡金属元素铁能形成多种配合物,如:[Fe (CN) 6] 4-、[Fe(SCN)6]3-等。
Fe3+的核外电子排布式为______________,从原子结构的角度解释Fe3+比Fe2+稳定的理由是_______________。
(2) N的基态原子中能量最高的电子,其电子云在空间有________个方向,原子轨道呈________形。
(3) (NH4)2SO4阴离子的立体构型是________,NH4+中心原子的杂化类型是________。
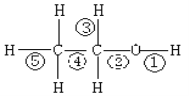
(4) Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:

① δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为____________g/cm3(列出算式即可)。
【答案】 [Ar]3d5 Fe3+的3d轨道为半充满状态,能量低稳定 3 哑铃(或纺锤) 正四面体形 sp3 4:3 4 
【解析】(1)Fe为26号元素,Fe3+的核外电子排布式为[Ar]3d5,Fe3+的3d轨道为半充满状态,能量低稳定,故Fe3+比Fe2+稳定;(2)因为氮原子的最外层有5个电子,其中2个是成对的,剩下的三个电子占据了三个p轨道,并且垂直分布,这样能量才能最低,则N的基态原子电子云在空间有3个方向,原子轨道呈哑铃或纺锤形;(3)(NH4)2SO4阴离子SO42-的中心S原子的价层电子对为:孤对电子数6-2×4+2=0,成键电子对数4,sp3杂化,其立体构型是四面体形;NH4+中N原子杂化轨道数为![]() ×(5+4-1)=4,采取sp3杂化方式;(4)①根据晶胞的结构可知,δ晶胞中以顶点铁原子为例,与之距离最近的铁原子是体心上的铁原子,这样的原子有8个,所以铁原子的配位数为8,α晶胞中以顶点铁原子为例,与之距离最近的铁原子是与之相连的顶点上的铁原子,这样的原子有6个,所以铁原子的配位数为6,所以δ、α两种晶体晶胞中铁原子的配位数之比为4:3;②利用均摊法计算得γ晶体晶胞中所含有的铁原子数为8×
×(5+4-1)=4,采取sp3杂化方式;(4)①根据晶胞的结构可知,δ晶胞中以顶点铁原子为例,与之距离最近的铁原子是体心上的铁原子,这样的原子有8个,所以铁原子的配位数为8,α晶胞中以顶点铁原子为例,与之距离最近的铁原子是与之相连的顶点上的铁原子,这样的原子有6个,所以铁原子的配位数为6,所以δ、α两种晶体晶胞中铁原子的配位数之比为4:3;②利用均摊法计算得γ晶体晶胞中所含有的铁原子数为8×![]() +6×
+6×![]() =4;③由晶胞示意图可知,δ-Fe单质为体心立方堆积,铁原子为面心和顶点,则一个晶胞中Fe的个数为1+8×
=4;③由晶胞示意图可知,δ-Fe单质为体心立方堆积,铁原子为面心和顶点,则一个晶胞中Fe的个数为1+8×![]() =2,一个晶胞的质量为
=2,一个晶胞的质量为![]() ,体心结构中,体对角线长为4rpm,晶胞边长为
,体心结构中,体对角线长为4rpm,晶胞边长为![]() ,晶胞体积为
,晶胞体积为![]() cm3,故密度为
cm3,故密度为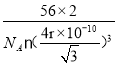 。
。

 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】近年来雾霾天气经常肆虐北京、天津、河北等地区,其中汽车尾气和燃煤是造成空气污染的原因之一。因此研究氮氧化物的反应机理,对消除和防治环境污染有重要意义。
(1) 对于2NO(g) + 2H2(g) = N2(g) + 2H2O(g) △H = 665 kJ/mol 的反应分三步完成:
① 2NO(g) = N2O2(g) (快)
② N2O2(g) + H2(g) = N2O(g) + H2O(g) (慢)
③ ______________________________ (快),请完成第③步的化学方程式。因此决定此总反应速率的是第_____步的反应。(填序号)
(2) 已知:H2(g) + CO2(g) = H2O(g) + CO(g) △H = + 41 kJ/mol汽车尾气的净化原理主要是用催化剂把NO与CO反应转化为两种对大气无污染的气体,试写出该反应的热化学方程式:______________。
该反应在一定条件下达到平衡后,为了能加快反应速率并让反应向正方向移动,可采取的措施有:(__________)
A.适当升高温度 B.适当降低温度 C.压缩体积增大压强 D.使用正催化剂
该反应采取上述措施重新达到平衡后K值将______(填“增大”、“减小”和“不变”)
(3) 升高温度能让绝大多数的化学反应加快反应速率,但是研究发现2NO(g) + O2(g) = 2NO2(g) △H < 0 存在一些特殊现象。现有某化学小组通过实验测得不同温度下该反应速率常数k (代表反应速率的一个常数)的数值如下表:
T(K) | k | T(K) | k | T(K) | k |
143 | 1.48 × 105 | 273 | 1.04 × 104 | 514 | 3.00 × 103 |
195 | 2.58 × 104 | 333 | 5.50 × 103 | 613 | 2.80 × 103 |
254 | 1.30 × 104 | 414 | 4.00 × 103 | 663 | 2.50 × 103 |
由实验数据测到v(正)~c(O2)的关系如图所示,当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为_____点(填字母),并解析原因:①__________,②__________。