题目内容
2NH3(g)+CO2(g)
 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)这是工业合成尿素的反应。如果将容器的容积缩小为原来的 1/3,则达到平衡时(平衡 B)下列说法一定正确的是( )
A.气体的平均式量比原来大 B.气体的平均式量比原来小
C.气体的平均式量与原来相等 D.依据题给条件无法确定
D
容器容积缩小,反应气体压强增大,合成尿素[CO(NH2)2]的反应向正反应方向移动,由反应方程式知,气体物质的量每减少 2 mol,就有 60 g 尿素生成——固体质量增加60 g,气体质量减少60 g。那么,可将平衡向右移动的结果虚拟为:将 30 g·mol-1的气体从反应容器中移出。
由于原混合气体平均式量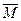 r(A)介于Mr(NH3)、Mr(CO2)、Mr(H2O)中最大者(44)与最小者(17)之间,故有以下讨论:
r(A)介于Mr(NH3)、Mr(CO2)、Mr(H2O)中最大者(44)与最小者(17)之间,故有以下讨论:
(1)若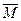 r(A)>30,则移走Mr=30的气体后,剩余气体平均式量增大,故有
r(A)>30,则移走Mr=30的气体后,剩余气体平均式量增大,故有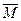 r(B)>
r(B)>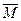 r(A)
r(A)
(2)若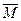 r(A)=30,则
r(A)=30,则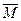 r(B)=
r(B)= 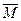 r(A),
r(A),
(3)若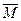 r(A)<30,则
r(A)<30,则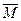 r(B)<
r(B)<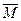 r(A)
r(A)
因为原混合气体的平均式量在题设条件下无法确定,所以新平衡建立后气体平均式量数值的变化无法确定。
由于原混合气体平均式量
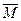 r(A)介于Mr(NH3)、Mr(CO2)、Mr(H2O)中最大者(44)与最小者(17)之间,故有以下讨论:
r(A)介于Mr(NH3)、Mr(CO2)、Mr(H2O)中最大者(44)与最小者(17)之间,故有以下讨论:(1)若
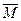 r(A)>30,则移走Mr=30的气体后,剩余气体平均式量增大,故有
r(A)>30,则移走Mr=30的气体后,剩余气体平均式量增大,故有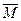 r(B)>
r(B)>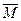 r(A)
r(A)(2)若
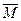 r(A)=30,则
r(A)=30,则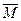 r(B)=
r(B)= 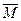 r(A),
r(A),(3)若
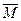 r(A)<30,则
r(A)<30,则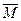 r(B)<
r(B)<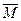 r(A)
r(A)因为原混合气体的平均式量在题设条件下无法确定,所以新平衡建立后气体平均式量数值的变化无法确定。

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
 2SO3体系中,加入一定量的18O2,足够长时间后,在_______________物质中存在18O原子。
2SO3体系中,加入一定量的18O2,足够长时间后,在_______________物质中存在18O原子。 xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:
xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应: 2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是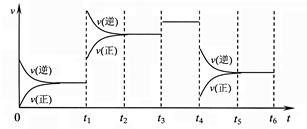
 CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g)
CO(g)+3H2(g);△H1=+216kJ/mol;CH4(g)+ CO2(g)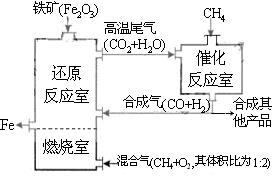
 xC(气)+2D(气)。经过5 min反应达到平衡,生成1mol D,经测定知C的平均反应速率为0.1mol/L(L·min)。与此有关的以下叙述中错误的是
xC(气)+2D(气)。经过5 min反应达到平衡,生成1mol D,经测定知C的平均反应速率为0.1mol/L(L·min)。与此有关的以下叙述中错误的是 B+3C处于平衡状态的是( )
B+3C处于平衡状态的是( )