题目内容
【题目】在炼油工业中常用醋酸铜氨溶液含{[Cu(NH3)2]+、CH3COO﹣和NH3}除去H2中的CO、O2及H2S气体.
(1)已知醋酸铜氨溶液吸收CO的反应为:[Cu(NH3)2]+(aq)+CO(g)+NH3(g)[Cu(NH3)2CO]+(aq).
若反应在恒容密闭容器中进行,则能说明该反应已达到平衡状态的是 .
a.v(CO)正=v(NH3)正
b.容器内气体压强不再随时间变化
c.[Cu(NH3)2]+浓度不再随时间变化
(2)醋酸铜氨溶液吸收CO一段时间后将失效,用下列方法可回收废醋酸铜氨溶液中的铜. 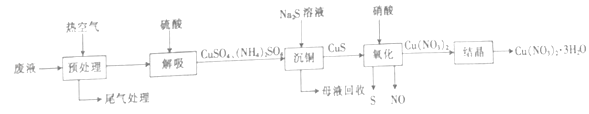
①“预处理”时,尾气中除N2、CO、O2、CO2及H2O外,还有 .
②加入硫化钠溶液时发生反应的离子方程式为 .
③加入硝酸时发生反应的化学方程式为 .
④已知上述流程中只有“沉铜”和“结晶”步骤铜元素有损耗.“沉铜”时铜元素的损耗率为4%;“结晶”时铜元素的损耗率为2%.若1L废液最终制得Cu(NO3)23H2O 363g,则1L废液中铜元素的质量为g.
【答案】
(1)bc
(2)NH3;Cu2++S2﹣=CuS↓;3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O;102
【解析】解:(1)a.无论反应是否达到平衡状态都存在v(CO)正=v(NH3)正 , 不能据此判断平衡状态,故错误;b.反应前后气体压强减小,当容器内气体压强不再随时间变化时,正逆反应速率相等,反应达到平衡状态,故正确;
c.[Cu(NH3)2]+浓度不再随时间变化时,正逆反应速率相等,反应达到平衡状态,故正确;
故选bc;(2)废液中通入热空气进行预处理,使醋酸铜氨分解得到尾气中有CO、氨气和剩余空气,向溶液中加入硫酸得到硫酸铜、硫酸铵,向硫酸铜、硫酸铵中加入硫化钠溶液得到CuS和母液,将CuS加入硝酸中得到S、NO和硝酸铜,将硝酸铜溶液蒸发浓缩、冷却结晶、过滤得到硝酸铜晶体①通过以上分析知,还有NH3 , 所以答案是:NH3;②硫酸铜和硫化钠发生复分解反应生成黑色沉淀CuS,离子方程式为Cu2++S2﹣=CuS↓,所以答案是:Cu2++S2﹣=CuS↓;③硝酸溶解CuS生成S、NO、硝酸铜和水,反应方程式为3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O,
所以答案是:3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2O;④363gCu(NO3)23H2O中Cu的质量=363g× ![]() ÷(1﹣2%)÷(1﹣4%)=102g,
÷(1﹣2%)÷(1﹣4%)=102g,
所以答案是:102.
【考点精析】利用化学平衡状态的判断对题目进行判断即可得到答案,需要熟知状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

