题目内容
【题目】KC1样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KC1,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作:
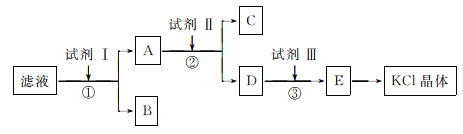
回答下列问题:
(1)为检验起始滤液中的Cl-,所用试剂除了稀硝酸,还需要_____________溶液。
(2)试剂I的化学式为________________,判断试剂I已加过量的方法是_____________。
(3)试剂Ⅱ的化学式为__________________,②中加入试剂Ⅱ的目的是__________________。
(4)试剂Ⅲ的名称是__________,③中发生反应的离子方程式为________________。
(5)某同学根据最终所得KC1晶体质量和原样品的质量计算出氯化钾样品的纯度,你认为结果可靠吗?并说明理由(不考虑实验误差):__________________________。
【答案】(1)硝酸银(或AgNO3);(2) BaCl2,取少量滤液A,加入试剂I,若无沉淀,则表明试剂I已加过量;(3) K2 CO3,除去前面引入的过量的Ba2+;(4)盐酸(或稀盐酸),CO32-+2 H+=H2O+CO2↑;(5)不可靠,所得KC1晶体并非完全来自原样品。
【解析】
试题分析:(1)检验Cl-:先加入硝酸,再加入AgNO3溶液,有白色沉淀产生,说明原溶液中含有Cl-;(2)滤液中加入BaCl2溶液,使CO32-和SO42-转化成BaCO3和BaSO4,检验BaCl2过量,取少量滤液A,加入试剂I,若无沉淀,则表明试剂I已加过量或加入Na2SO4溶液,如果有白色沉淀生成,说明BaCl2溶液过量;(3)试剂II,除去过量氯化钡溶液,不引入新杂质,因此选用K2CO3溶液;(4)试剂III的目的是除去过量碳酸钾溶液,不引入杂质,因此加入盐酸,发生的反应是CO32-+2 H+=H2O+CO2↑;(5)不可靠,在步骤③中生成KCl,所得KC1晶体并非完全来自原样品。

 优加精卷系列答案
优加精卷系列答案