题目内容
设反应CO2(g) + H2(g)![]() CO(g) + H2O(g) 的平衡常数为K,在不同温度下,K 的值如下:
CO(g) + H2O(g) 的平衡常数为K,在不同温度下,K 的值如下:
温度 | 830℃ | 1200℃ |
K | 1 | 2.6 |
(1)从上表可以推断:该反应的逆反应是 (填“吸”、“放”)热反应。
(2)在一体积为10 L的密闭容器中,加入一定量的CO2和H2(g),在830℃时发生上述反应,容器中各物质的浓度变化(mol/L)见下表:
时间/min | CO2 | H2 | CO | H2O |
0 | 0.100 | 0.100 | 0 | 0 |
2 | 0.065 | 0.065 | 0.035 | 0.035 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.050 | 0.050 | 0.050 | 0.050 |
6 | 0.035 | 0.0350 | 0.065 | c4 |
①前2min,用CO2表示的该化学反应的速率是
②表中3min―4min之间反应处于_________状态
③表中第5min时,该反应是否处于化学平衡状态? (填“是”或“否”),此时化学反应速率是ν正 ν逆(填“大于”、“小于”或“等于”),其原因是
④表中5min―6min之间数值发生变化,可能的原因是
a.减少了水蒸气 b.升高温度 c.使用催化剂 d.增大压强
(1)放热 (1分)
(2)① 0.0175mol/L•min (1分)
②平衡(1分)
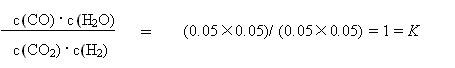
③ 是 ,等于 ,(每空1分,共3分)
④ a、b (2分)

(10分)设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下, K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下, K1、K2的值如下:
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
(1)平衡常数K1的表达式为 ________________ 。
(2)现有反应③ CO2(g) +H2(g)
 CO(g) +H2O(g);△H>0,这是一个 (填“吸”或“放”) 热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有 。
CO(g) +H2O(g);△H>0,这是一个 (填“吸”或“放”) 热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有 。A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(3)若反应Fe(s)+CO2(g)
 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率 (填序号)。A.前者大 B.后者大 C.一样大 D.无法判断
(4)以下图像:(图中v为速率,φ为生成物的百分含量,T为温度)

其中符合反应①的是 _________ (填图像序号,下同),符合反应②的是 ___ 。
I.设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,
FeO(s)+H2(g)的平衡常数为K2,
在不同温度下,K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)
 CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)
 FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
(填序号)
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
(填序号)
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。则100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=________mol·L-1,KW(25℃)________KW(100℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4HCO3固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
|
化学式 |
电离平衡常数(25℃) |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为 ____。
②25 ℃时,相同浓度、相同体积的CH3COOH溶液和NaOH溶液混合, 则混合溶液中c(Na+)________c(CH3COO-)(填“>”、“<”或“=”)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为_______________________________。
I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有
(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)  FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号)。
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。请配平主要反应的方程式:
□Na2FeO2+□NaNO2+□H2O=□NaFeO2+□NH3↑+□NaOH
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。

①图示可知,分析HNO3与铁反应的规律是 。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是 。
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铬等金属制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
(10分)设反应①Fe(s)+CO2(g)  FeO(s)+CO(g)的平衡常数为K1。
FeO(s)+CO(g)的平衡常数为K1。
反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下, K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下, K1、K2的值如下:
|
T(K) |
K1 |
K2 |
|
973 |
1.47 |
2.36 |
|
1173 |
2.15 |
1.67 |
(1)平衡常数K1的表达式为 ________________ 。
(2)现有反应③ CO2(g) +H2(g)  CO(g) +H2O(g);△H>0,这是一个 (填“吸”或“放”) 热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有
。
CO(g) +H2O(g);△H>0,这是一个 (填“吸”或“放”) 热反应,要使反应③在一定条件下建立的平衡向右移动,可采取的措施的有
。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(3)若反应Fe(s)+CO2(g)  FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
 FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率
(填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(CO)(其他条件均相同),则两者的反应速率
(填序号)。
A.前者大 B.后者大 C.一样大 D.无法判断
(4)以下图像:(图中v为速率,φ为生成物的百分含量,T为温度)

其中符合反应①的是 _________ (填图像序号,下同),符合反应②的是 ___ 。