题目内容
(2013?绍兴一模)下列溶液中离子浓度的关系一定正确的是( )
分析:A.根据溶液中的溶质判断离子浓度大小关系;
B.根据物料守恒判断;
C.pH相同的不同钠盐溶液中,阴离子的水解程度越大,钠盐的物质的量浓度越小;
D.根据酸和碱的相对强弱判断.
B.根据物料守恒判断;
C.pH相同的不同钠盐溶液中,阴离子的水解程度越大,钠盐的物质的量浓度越小;
D.根据酸和碱的相对强弱判断.
解答:解:A.当得到的是氯化铵溶液时,离子浓度大小关系是c(Cl-)>c(NH4+)>c(H+)>c(OH-),当盐酸的物质的量远远大于氨水的物质的量时,离子浓度大小关系是c(Cl-)>c(H+)>c(NH4+)>c(OH-),故A错误;
B.根据物料守恒得c(K+)=c(H2X)+c(HX-)+c(X2-),故B正确;
C.pH相同的不同钠盐溶液中,阴离子的水解程度越大,钠盐的物质的量浓度越小,这几种离子的水解程度大小顺序是CO32->C6H5O->CH3COO-,所以c(CH3COO-)>c(C6H5O-)>c(CO32-),故C错误;
D.等酸和碱都是强电解质时,溶液呈中性,溶液中存在c(M+)=c(X-)>c(H+)=c(OH-),当酸的强度大于碱的强度时,混合溶液呈碱性,则c(H+)<c(OH-),当酸的强度小于碱的强度时,混合溶液呈酸性,则c(H+)>c(OH-),故D错误;
故选B.
B.根据物料守恒得c(K+)=c(H2X)+c(HX-)+c(X2-),故B正确;
C.pH相同的不同钠盐溶液中,阴离子的水解程度越大,钠盐的物质的量浓度越小,这几种离子的水解程度大小顺序是CO32->C6H5O->CH3COO-,所以c(CH3COO-)>c(C6H5O-)>c(CO32-),故C错误;
D.等酸和碱都是强电解质时,溶液呈中性,溶液中存在c(M+)=c(X-)>c(H+)=c(OH-),当酸的强度大于碱的强度时,混合溶液呈碱性,则c(H+)<c(OH-),当酸的强度小于碱的强度时,混合溶液呈酸性,则c(H+)>c(OH-),故D错误;
故选B.
点评:本题考查离子浓度大小的比较,明确溶液中存在的溶质及溶质类型是解本题关键,难度中等.

练习册系列答案
相关题目
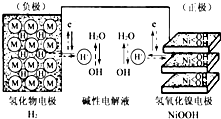 (2013?绍兴一模)航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应).白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电.下列说法正确的是( )
(2013?绍兴一模)航天器中常使用可充电电池,构造示意图如图(氢化物电极为储氢金属,可看做H2直接参加反应).白天太阳能帆板发电,将一部分电量储存在镍氢电池里,夜晚镍氢电池供电.下列说法正确的是( )