题目内容
把NH4Cl从几乎饱和的NaHCO3溶液中分离出来是联合制碱法中的关键。为此,应向混合溶液中通入某种气体,同时加入磨细的食盐,可获得不含NaHCO3的NH4Cl。NH4Cl和NaCl共同存在时的溶解度曲线如下图所示: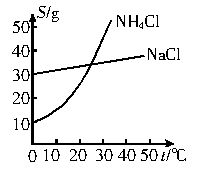
下列操作正确的是( )。

D
【试题分析】
解析:本题以联合制碱法中关键反应步骤为切入点,将化学反应原理、物质性质、溶解度曲线分析等融合在一起,考查同学们理论联系实际,解决具体问题的能力。联合制碱法制NH4Cl和NaHCO3的化学方程式为:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl,两种气体中NH3的溶解度较大,应先通入,能保证CO2的充分吸收,反之,通入CO2来吸收NH3的效果则较差。由溶解度曲线图可知:0℃~10℃时,NH4Cl的溶解度较小一些,控制温度在此范围,NH4Cl易变为晶体析出(温度对NaCl的溶解性影响不大)。

练习册系列答案
相关题目
把NH4Cl从几乎饱和的NaHCO3溶液中分离出来是联合制碱法中的关键。为此,应向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不含NaHCO3的NH4Cl。NH4Cl和NaCl共同存在时的溶解度曲线如上图所示,下列操作正确的是( )
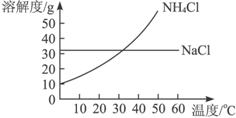
组别 | 通入气体 | 控制温度 |
A | CO2 | 30—40 ℃ |
B | CO2 | 0—10 ℃ |
C | NH3 | 30—40 ℃ |
D | NH3 | 0—10 ℃ |

