题目内容
下列各粒子半径依次增加的是( )
分析:电子层结构相同的离子的半径与其原子序数成反比;同一元素的原子半径<其阴离子半径,阳离子半径<原子半径;
同一主族,相同类型的阴离子或阳离子,根据元素周期律判断,不同周期的相同电性的离子,核电荷数越大,离子半径越大..
同一主族,相同类型的阴离子或阳离子,根据元素周期律判断,不同周期的相同电性的离子,核电荷数越大,离子半径越大..
解答:解:A、Cs+、K+是同一主族相同类型的阳离子,核电荷数越大,离子半径越大,K+的电子层数大于Mg2+、Al3+,所以钾离子半径大于镁离子、铝离子半径,故A错误.
B、F-、Cl-、Br-是同一主族相同类型的阴离子,核电荷数越大,离子半径越大,所以氟离子半径<氯离子半径<溴离子半径,氟原子半径小于氟离子半径,故B正确.
C、电子层结构相同的离子的半径与其原子序数成反比,Ca2+、K+、S2-、Cl-电子层结构相同,所以钙离子半径<钾离子半径<氯离子半径<硫离子半径,故C错误.
D、钾原子电子层数大于铝原子、镁原子电子层数,所以钾原子半径大于铝原子、镁原子半径,镁、铝属于同一周期,根据元素周期律知,镁原子半径大于铝原子半径,同一元素的原子半径大于阳离子半径,所以铝离子半径小于铝原子半径,故D错误.
故选B.
B、F-、Cl-、Br-是同一主族相同类型的阴离子,核电荷数越大,离子半径越大,所以氟离子半径<氯离子半径<溴离子半径,氟原子半径小于氟离子半径,故B正确.
C、电子层结构相同的离子的半径与其原子序数成反比,Ca2+、K+、S2-、Cl-电子层结构相同,所以钙离子半径<钾离子半径<氯离子半径<硫离子半径,故C错误.
D、钾原子电子层数大于铝原子、镁原子电子层数,所以钾原子半径大于铝原子、镁原子半径,镁、铝属于同一周期,根据元素周期律知,镁原子半径大于铝原子半径,同一元素的原子半径大于阳离子半径,所以铝离子半径小于铝原子半径,故D错误.
故选B.
点评:本题考查了离子半径大小的半径,难度不大,同一主族的元素,其相同类型的离子半径或原子半径比较,根据元素周期律判断即可,电子层结构相同的离子的半径与其原子序数成反比.

练习册系列答案
相关题目
下列各微粒半径依次增大的是
[ ]
|
A.F、 |
B. |
|
C. |
D. |
下各各微粒半径依次增加的是( )
| A.Cs+、K+、Mg+、Al3+ | B.F、F―、Cl―、Br― |
| C.Ca2+、K+、Cl―、O2― | D.Al、Al3+、Mg、K |
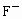 、
、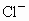 、
、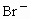
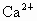 、
、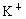 、
、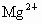 、
、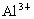
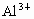 、Al、Mg、K
、Al、Mg、K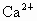 、
、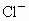 、
、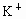 、
、