题目内容
(07年北京卷)一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是()
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是()
A.以X浓度变化表示的反应速率为0.001mol/(L?S)
B.将容器体积变为20L,Z的平衡浓度变为原来的![]()
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
答案:A
解析:根据题目的含义可以列出:
2X(g) + Y(g) ![]() Z(g)
Z(g)
起始(mol?L-1)0.1 0.1 0
转化(mol?L-1)0.06 0.03 0.03
平衡(mol?L-1)0.04 0.07 0.03
所以v=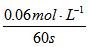 =0.001mol/(L?S),故A选项正确;若将容器的体积变为20L,各物质的浓度均减半,根据平衡移动原理此平衡应向逆反应方向移动,所以Z的平衡浓度比原来的
=0.001mol/(L?S),故A选项正确;若将容器的体积变为20L,各物质的浓度均减半,根据平衡移动原理此平衡应向逆反应方向移动,所以Z的平衡浓度比原来的![]() 要小,故B选项错误;由于此反应的正反应是气体体积减小的反应,因此增大压强此平衡向右移动,反应物X和Y的转化率均增大,故C选项错误;X的体积分数增大,说明平衡向逆反应方向移动,而升高温度平衡应向吸热反应方向移动,因此此反应的正反应应为放热反应,即△H<0,所以D选项错误。
要小,故B选项错误;由于此反应的正反应是气体体积减小的反应,因此增大压强此平衡向右移动,反应物X和Y的转化率均增大,故C选项错误;X的体积分数增大,说明平衡向逆反应方向移动,而升高温度平衡应向吸热反应方向移动,因此此反应的正反应应为放热反应,即△H<0,所以D选项错误。
高考考点:化学反应速率的计算,化学平衡的移动。
易错提醒:忽略化学反应速率为单位时间内物质溶度的变化而错需其他选项;对平衡移动原理(勒夏?特列原理)理解片面而错选B或D。
备考提示:要学会应用“三段式”解决化学反应速率和化学平衡的有关计算;对化学平衡移动原理既要理解其含义(定性和定量两个方面),又要灵活应用、举一反三。在备考复习时要针对这部分内容要加大训练力度。

 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案(07年北京卷)(13分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
 |
已知: a.常见双原子单质分子中,X分子含共价键最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_______ 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
 |
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式)。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 ___________ 。
(07年北京卷) 某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
实验步骤 | 实验现象 |
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中。 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色。 |
反应结束后分离出溶液备用 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中。 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应 ;
化合反应 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是___。
解释此现象的离子方程式是 。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来。
① 用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)________。
② MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是
。