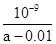题目内容
下列各组溶液中,可能大量共存的离子组有
| A.加入Al粉后反应产生H2的溶液中:NH4+、Na+、SiO32-、HCO3- |
| B.滴加甲基橙试液后呈红色的溶液中: Na+、 CO32-、 K+、 AlO2- |
| C.水电离产生的c(OH-)=1×11-11mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
| D.含有大量I—的溶液中:K+、Mg2+、ClO-、SO42- |
C
试题分析:离子间如果发生化学反应则不能大量共存,反之是可以的。A、加入Al粉后反应产生H2的溶液可能显酸性,也可能显碱性。如果显酸性,则SiO32-、HCO3-不能大量共存。如果显碱性,则NH4+、HCO3-不能大量共存;B、滴加甲基橙试液后呈红色的溶液显酸性,CO32-、 AlO2-不能大量共存;C、水电离产生的c(OH-)=1×11-11mol/L的溶液,说明该溶液中水的电离被抑制,溶液可能显酸性,也可能显碱性。如果显酸性,可以大量共存。如果显碱性,则Al3+不能大量共存;D、ClO-具有强氧化性,能氧化I—,因此正确的答案选C。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
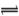 X2—+H+。回答下列问题:
X2—+H+。回答下列问题: (2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大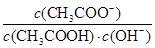 减小
减小