题目内容
常温下,将22.4gCu和Fe2O3的混合粉末加入到足量1mol·L-1的H2SO4溶液中,反应后溶液的体积为1 L测得溶液中Fe2+;浓度为0.1mol·L-l,求混合物中Cu的质量。
3.2g或14.4g
解:n(Fe2+)=0.1 mol/L×l L=0.1 mol即n(Fe3+)=0.1 mol
溶液中发生的反应有两个:
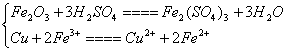
(1)假设Cu完全反应,设Cu为xmol
Cu+2 Fe3+====Cu2++2Fe2+
1mol 2mol
x 0.1 mol
x=0.05mol
∴![]() =0.05mol×64g/mol=3.2g
=0.05mol×64g/mol=3.2g
(2)假设Fe2O3完全反应,设Fe2O3为ymol
Fe2O3+3 H2SO4====Fe2(SO4)3+3H2O
1 mol 1mol
y 0.05 mol
y=0.05 mol
∴![]() =0.05 mol×160g/mol=8g
=0.05 mol×160g/mol=8g
∴![]() =m总-
=m总-![]() =22.4-8=14.4 g
=22.4-8=14.4 g

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 mol·L-1
mol·L-1