题目内容
在PCl3中加入蒸馏水,微热,PCl3完全水解生成亚磷酸(H3PO3)易溶于水,与NaOH溶液反应只能生成NaH2PO3和Na2HPO3两种盐。根据以上事实回答:
(1)H3PO3属于________元酸。
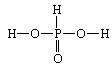
(2)H3PO3结构简式为________。
(3)H3PO3与足量NaOH反应的化学方程式为________。
答案:
解析:
解析:
(1)二(2) (3)H3PO3+2NaOH=Na2HPO3+2H2O
|

练习册系列答案
相关题目
用图示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃)。已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
| | 熔点 | 沸点 |
| PCl3 | -112℃ | 75℃ |
| PCl5 | 148℃ | 200℃ |

请根据图中装置回答下列问题:
(1)检查该装置气密性的方法是 。
(2)为得到氯气,若B中加入MnO2,则A中应加入 ,反应的化学方程式为___________________________________ 。
(3)若发现C中气泡产生过猛,需要进行的操作或对装置进行的改进是 。
(4)在反应开始时主要生成PCl3,而后来主要生成PCl5,原因可能是 ;从PCl3和PCl5的混合物中分离出PCl3的方法是 (选填序号)。
a.蒸馏 b.过滤 c.分液 d.升华
(5)生成的PCl3在G中收集
 ,则F中盛有 ,作用是______________________。
,则F中盛有 ,作用是______________________。(6)C、D、H所盛的试剂分别是(选填序号):C ; D ; H 。
a.饱和食盐水 b.浓硫酸 c.无水氯化钙 d.碱石灰
(7)如果E中反应放热较多,G处的导管可能发生堵塞,其原因是 。
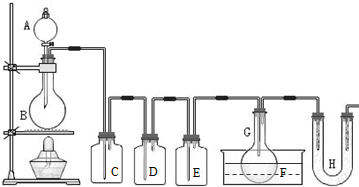 (2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
(2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:

