题目内容
【题目】(NH4)2Cr2O7用于有机合成催化剂,媒染剂,显影液等。某化学兴趣小组对(NH4)2Cr2O7的部分性质及组成进行探究。已知:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。回答下列问题:
2CrO42-(黄色)+2H+。回答下列问题:
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,观察到的主要现象是固体溶解、__________、__________。
(2)为探究(NH4)2Cr2O7 (摩尔质量252g/mol)的分解产物,按下图连接好装置,在A中加入5.040g样品进行实验。
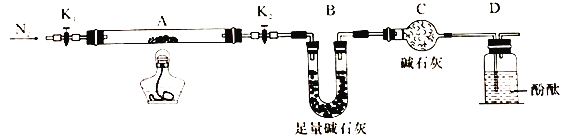
①仪器B的名称是__________。
②加热A至恒重,观察到D中溶液不变色,同时测得A、B中质量变化分别为2.00g、1.44g,写出重铬酸铵加热分解反应的化学方程式____________________。
③C的作用是__________。
(3)实验室常用甲醛法测定含(NH4)2Cr2O7的样品中氮的质量分数,其反应原理为:2Ba2++Cr2O72-+H2O=2BaCrO4↓+2H+、 4NH4++6HCHO =3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。
实验步骤:称取样品2.800g,配成250mL溶液,移取25.00mL样品溶液于250mL锥形瓶中,用氯化钡溶液使Cr2O72-完全沉淀后,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用0.200 mol·L-1 NaOH标准溶液滴定至终点。重复上述操作3次。
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则滴定时用去NaOH标准溶液的体积__________ (填“偏大”、“偏小”或“无影响”);滴定时边滴边摇动锥形瓶,眼睛应观察__________。
【答案】有刺激性气味气体放出 溶液变为黄色 U形管 (NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O 防止水蒸气进入到B中 偏大 锥形瓶内溶液颜色的变化
Cr2O3+N2↑+4H2O 防止水蒸气进入到B中 偏大 锥形瓶内溶液颜色的变化
【解析】
(1)滴加足量浓KOH溶液,NH4+会与OH-反应后加热会生成氨气,结合已经条件,考虑氢氧根离子对溶液中的离子平衡的影响作答;
(2)①依据基本实验仪器的构造与用途作答;
②依据质量守恒定律作答;
③从测量水蒸气质量的准确性考虑;
(3)结合c(测) = ![]() 和酸碱中和滴定的正确操作作答;
和酸碱中和滴定的正确操作作答;
(1)在试管中加入少量(NH4)2Cr2O7固体,滴加足量浓KOH溶液,振荡、微热,NH4+会与OH-反应其离子方程式为:NH4+ + OH- ![]() NH3↑ +H2O,则有刺激性气味的气体生成,同时加入OH-后,促进Cr2O72-(橙色)+H2O
NH3↑ +H2O,则有刺激性气味的气体生成,同时加入OH-后,促进Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+向正反应方向移动,溶液变黄色,
2CrO42-(黄色)+2H+向正反应方向移动,溶液变黄色,
故答案为:有刺激性气味气体放出;溶液变为黄色;
(2)①根据仪器的构造可知,该仪器名称为U形管,
故答案为:U形管;
②(NH4)2Cr2O7的物质的量为![]() = 0.02 mol,加热A至恒重,观察到D中溶液不变色,同时测得A质量变化为2.00 g,则剩余固体质量为5.040 g -2.00 g = 3.040 g,根据元素守恒法已知,剩余固体为Cr2O3,其物质的量为
= 0.02 mol,加热A至恒重,观察到D中溶液不变色,同时测得A质量变化为2.00 g,则剩余固体质量为5.040 g -2.00 g = 3.040 g,根据元素守恒法已知,剩余固体为Cr2O3,其物质的量为![]() = 0.02 mol,碱石灰吸收水蒸气,增重1.44 g,则生成的水的物质的量为
= 0.02 mol,碱石灰吸收水蒸气,增重1.44 g,则生成的水的物质的量为![]() = 0.08 mol,结合原子守恒可知,N原子的质量为0.02 mol×14×2 = 0.56 g,而实际质量差为5.040 g -3.040 g -1.44 g = 0.56 g,另一种产物为N2,即其化学方程式为:(NH4)2Cr2O7
= 0.08 mol,结合原子守恒可知,N原子的质量为0.02 mol×14×2 = 0.56 g,而实际质量差为5.040 g -3.040 g -1.44 g = 0.56 g,另一种产物为N2,即其化学方程式为:(NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O,
Cr2O3+N2↑+4H2O,
故答案为:(NH4)2Cr2O7![]() Cr2O3+N2↑+4H2O;
Cr2O3+N2↑+4H2O;
③为避免外界空气中的水蒸气进入装置干扰实验设计安装C装置;
(3)碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则导致标准液浓度偏低,根据c(测) = ![]() 可知,最终滴定时用去NaOH标准溶液的体积偏大;滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化,
可知,最终滴定时用去NaOH标准溶液的体积偏大;滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶内溶液颜色的变化,
故答案为:锥形瓶内溶液颜色的变化。

 星级口算天天练系列答案
星级口算天天练系列答案【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理,对于消除环境污染有重要意义。请回答下列问题:
(1)已知:H2的燃烧热△H为-285.8kJ/mol。
N2(g)+2O2(g)=2NO2(g) △H=+133 kJ/mol
H2O(g)=H2O(1) △H=-44 kJ/mol
则H2和NO2反应生成两种无污染的气体的热化学反应方程式为______________________。
(2)一定温度下,向2L恒容密闭容器中充入0.40molN2O4,发生反应:N2O4(g)![]() 2NO2(g),一段时间后达到平衡,测得数据如下:
2NO2(g),一段时间后达到平衡,测得数据如下:
时间/s | 20 | 40 | 60 | 80 | 100 |
c(NO2)/(mol/L) | 0.12 | 0.20 | 0.26 | 0.30 | 0.30 |
①0~40s内,v(NO2)=___________。
②升高温度时,气体颜色加深,则上述反应是___________(填“放热”或“吸热”)反应。
③该温度下反应的化学平衡常数K=___________。
④相同温度下,若开始向该容器中充入0.80molN2O4,则达到平衡后c(NO2)___________(填“>”=”或”<”)0.60mol/L
(3)已知2NO(g)+O2(g)![]() 2NO2(g) △H的反应历程分两步:
2NO2(g) △H的反应历程分两步:
①2NO(g)![]() N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0,v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g)![]() 2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
2NO2(g)(慢) △H2<O,v2正=k2正c (N2O2)·c(O2),v2逆=k2逆c 2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________E2(填“>”“<”或“=”),其判断理由是____________________;2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正/span>、k2逆的关系式为______________________。
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正/span>、k2逆的关系式为______________________。
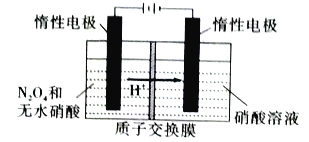
(4)N2O5是绿色硝化试剂,溶于水可得硝酸。下图是以N2O4为原料电解制备N2O的装置。写出阳极区生成N2O5的电极反应式(注意阳极区为无水环境,HNO3亦无法电离): _________________________________。
【题目】I.(1)三种弱酸HA、H2B、HC,电离平衡常数的数值为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
① HA + HB- (少量)=A-+ H2B,② H2B(少量) + C-=HB-+ HC,③ HA(少量) + C-=A-+ HC 。
则三种酸对应的电离平衡常数分别为(请在下面填空):________
HA | H2B | HC | ||
Ka | Ka1 | Ka2 | Ka3 | Ka4 |
数值 | ||||
(2)常温下0.1 mol/L CH3COOH溶液加水稀释过程,下列表达式数据一定变小是________。
A.c(H+) B.n(H+) C. c(CH3COO-)/ c(H+) D.c(CH3COOH)/c(H+)
II.工业废水中常含有一定量的Cr2O72- 和CrO42-,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。

(1)转化过程中存在平衡2CrO42- + 2H+![]() Cr2O72- + H2O能说明反应到达平衡状态的是____。
Cr2O72- + H2O能说明反应到达平衡状态的是____。
A.CrO42-和Cr2O72-的浓度相同 B.ν正(Cr2O72-)=2 ν逆(CrO42-)
C.溶液的pH值保持不变 D.溶液颜色保持不变
(2)若1 L转化后所得溶液中含铬元素质量为28.6 g,CrO42- 有10/11转化为Cr2O72-(已知铬元素相对原子质量为52)。
① 转化后所得溶液中c(Cr2O72-)=_________________。
② 已知:常温下该反应的平衡常数K=1014,上述溶液转化后H+的物质的量浓度为_________。
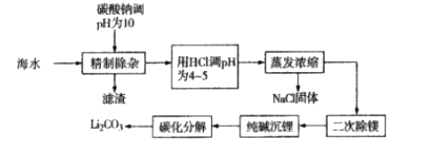
【题目】从海水中提取并制备碳酸锂,可以提高海水的综合利用价值,满足工业上对碳酸锂的需求。制备碳酸锂的一种工艺流程如下:
已知:①海水中某些离子浓度如下:
离子 | Li+ | Mg2+ | Ca2+ | Mn2+ | Cl- |
浓度(mol/L) | 0.113 | 0.049 | 0.001 | 0.010 | 0.501 |
②碳酸锂的溶解度:
温度(℃) | 0 | 10 | 30 | 50 | 70 | 90 |
溶解度(g/L) | 1.54 | 1.43 | 1.25 | 1.08 | 0.91 | 0.83 |
![]() 几种难溶电解质的溶度积(25℃):
几种难溶电解质的溶度积(25℃):
物质 | Li2CO3 | MgCO3 | MnCO3 | CaCO3 | Mg(OH)2 |
Ksp | 2.5×10-2 | 6.8×10-6 | 2.3×10-11 | 2.8×10-9 | 6×10-10 |
请回答下列问题:
![]() 精制除杂阶段的滤渣为MgCO3、______
精制除杂阶段的滤渣为MgCO3、______![]() 写化学式
写化学式![]()
![]() 用HCl调pH为4~5的目的是_________。
用HCl调pH为4~5的目的是_________。
![]() 二次除镁过程中,若使Mg2+浓度为6×10-4mol/L,应控制pH为______。
二次除镁过程中,若使Mg2+浓度为6×10-4mol/L,应控制pH为______。
![]() 沉锂阶段,实际测得不同纯碱加入量条件下的碳酸锂沉淀结果如下表:
沉锂阶段,实际测得不同纯碱加入量条件下的碳酸锂沉淀结果如下表:
序号 |
| 沉淀质量(g) | Li2CO3含量(%) | 锂回收率(%) |
0.9:2.0 | 10.09 | 92.36 | 77.67 | |
1.0:2.0 | 10.97 | 90.19 | 82.46 | |
1.1:2.0 | 11.45 | 89.37 | 85.27 | |
1.2:2.0 | 12.14 | 84.82 | 85.85 |
综合以上信息及考虑实际生产时的原料成本,应按照______![]() 填序号
填序号![]() 中CO32-与Li+物质的量之比加入纯碱制备碳酸锂。
中CO32-与Li+物质的量之比加入纯碱制备碳酸锂。
![]() 沉锂温度需控制在
沉锂温度需控制在![]() ,主要原因是______。
,主要原因是______。
![]() 碳化分解具体过程为:①向碳酸锂与水的浆料中通入CO2气体,充分反应后,过滤;②加热滤液使其分解。写出②反应中的化学方程式:__________。写出在碳化分解中可循环利用物质的电子式:_________。
碳化分解具体过程为:①向碳酸锂与水的浆料中通入CO2气体,充分反应后,过滤;②加热滤液使其分解。写出②反应中的化学方程式:__________。写出在碳化分解中可循环利用物质的电子式:_________。
