题目内容
已知某亚铁盐的化学式可表示为(NH4)a Feb(SO4)c.取一定质量的该亚铁盐样品全部溶于足量的水中,将所得溶液平均分为两份.一份溶液中加入足量的BaCl2溶液,得到白色沉淀9.32g.另一份溶液同足量的浓NaOH溶液共热,产生的氨气用100mL 0.5mol?L-1稀硫酸吸收后(设产生的氨全部逸出),剩余的硫酸再用1.5mol?L-1NaOH溶液中和,需NaOH溶液40mL.该亚铁盐样品中b:c的比值为( )
| A、1:1 | B、2:1 | C、1:2 | D、3:2 |
分析:利用BaSO49.32g可以求出硫酸根离子的物质的量,利用氨气消耗的氢离子的物质的量计算出氨气的物质的量及铵离子的物质的量,从而可知铵根离子与硫酸根离子的物质的量之比,用c表示铵根离子和硫酸根离子,然后根据化合物中总化合价为0计算出b与c 的物质的量之比.
解答:解:9.32g白色沉淀BaSO4的物质的量为:n(BaSO4)=
=0.04mol,含有的硫酸根离子的物质的量为:n(SO42-)=n(BaSO4)=0.04mol;
100mL 0.5mol?L-1稀硫酸中含有氢离子物质的量为:n(H+)=0.5mol?L-1×0.1L×2=0.1mol,
氢氧化钠中和的硫酸中氢离子的物质的量为:1.5mol?L-1×0.04L=0.06mol,
与NH3反应的H+的物质的量为:0.1mol-0.06mol=0.04mol,
所以:n(NH4+):n(SO42-)=0.04:0.04=1:1,
即该亚铁盐的化学式可表示为:(NH4)c Feb(SO4)c,
根据综合价为0可知:(+1)×c+(+2)×b+(-2)×c=0,
整理得:c=2b,即 b:c=1:2,
故选C.
| 9.32g |
| 233g/mol |
100mL 0.5mol?L-1稀硫酸中含有氢离子物质的量为:n(H+)=0.5mol?L-1×0.1L×2=0.1mol,
氢氧化钠中和的硫酸中氢离子的物质的量为:1.5mol?L-1×0.04L=0.06mol,
与NH3反应的H+的物质的量为:0.1mol-0.06mol=0.04mol,
所以:n(NH4+):n(SO42-)=0.04:0.04=1:1,
即该亚铁盐的化学式可表示为:(NH4)c Feb(SO4)c,
根据综合价为0可知:(+1)×c+(+2)×b+(-2)×c=0,
整理得:c=2b,即 b:c=1:2,
故选C.
点评:本题考查了复杂化学式的确定方法,题目难度中等,注意掌握确定复杂化学式的方法,明确质量守恒定律以及化合物中总化合价为0是解题的关键.

练习册系列答案
相关题目
磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池的电极材料。某化工厂以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如下:
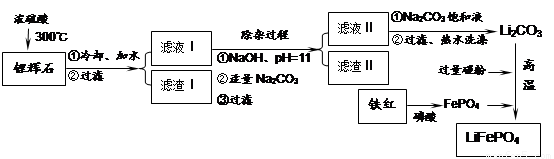
已知:2LiAl(SiO3)2
+ H2SO4(浓) 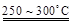 Li2SO4 + Al2O3·4SiO2·H2O↓
Li2SO4 + Al2O3·4SiO2·H2O↓
|
温度/℃ |
20 |
40 |
60 |
80 |
|
溶解度(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
溶解度(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣Ⅰ中可分离出Al2O3,如下图所示。请写出生成沉淀的离子方程式 。

(2)滤渣Ⅱ的主要成分是: (填化学式)。
(3)向滤液Ⅱ中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)写出在高温下生成磷酸亚铁锂的化学方程式 。
(5)磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:
。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为
。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池放电时的正极反应:
。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为
。