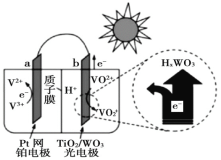
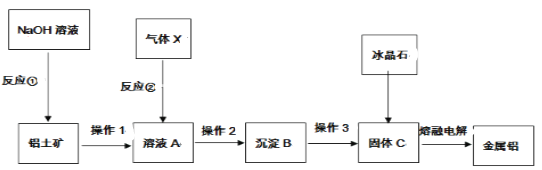
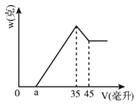
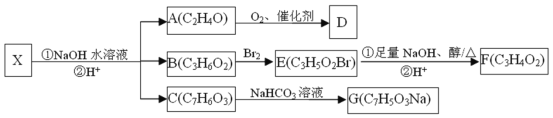
题目内容
【题目】某温度下,向0.10mol/L的HCOONH4溶液中通入HCl或加入NaOH固体调节溶液pH(忽略溶液体积变化),部分粒子的浓度随pH的变化关系如图所示。其中[NH3]表示溶液中NH3与NH3·H2O的浓度之和,M点的坐标为(6.5,-4)。下列说法不正确的是
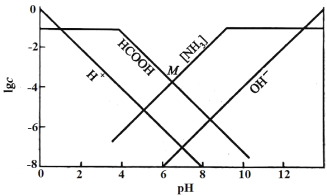
A.此温度下,Kw=1.0×10-14
B.pH<12时,溶液中[NH3]>c(OH-)
C.M点有c(HCOO-)>c(HCOOH)>c(NH4+)>c(H+)>c(OH-)
D.Ka(HCOOH)的数量级为10-4
【答案】C
【解析】
A.由图示可知,当溶液pH=6时,lgc(OH-)=-8,即此时c(OH-)=10-8mol/L,c(H+)=10-6mol/L,Kw= c(OH-)× c(H+)=1.0×10-14,故A正确;
B.由图示可知,pH<12时,溶液中表示[NH3]的曲线始终在表示c(OH-)的曲线上方,说明溶液中[NH3]>c(OH-),故B正确;
C.M点的坐标为(6.5,-4),此时溶液的pH=6.5,溶液中[NH3] =c(HCOOH)=10-4mol/L,根据物料守恒c(NH4+)=0.10mol/L-[NH3] =0.10mol/L-10-4mol/L,c(HCOO-)=0.10mol/L-c(HCOOH)= 0.10mol/L-10-4mol/L,则此时溶液中c(HCOO-)>c(NH4+)>c(HCOOH) >c(H+)>c(OH-),故C错误;
D.M点的坐标为(6.5,-4),此时溶液的pH=6.5,溶液中c(HCOOH)=10-4mol/L,已知HCOO-+H2O![]() HCOOH+OH-,则
HCOOH+OH-,则![]() =
=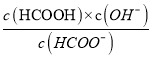 ,Ka(HCOOH)=
,Ka(HCOOH)=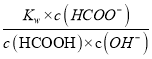 =
=![]() =10-3.5=
=10-3.5=![]() ×10-4,即Ka(HCOOH)的数量级为10-4,故D正确;
×10-4,即Ka(HCOOH)的数量级为10-4,故D正确;
故答案为C。

 阅读快车系列答案
阅读快车系列答案