题目内容
【题目】CO是现代化工生产的基础原料,下列有关问题都和CO的使用有关。
(1) 利用CO生产乙醇: 2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g) ΔH1
CH3CH2OH(g)+H2O(g) ΔH1
又已知:H2O(l)=== H2O(g)ΔH2 CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
工业上也可利用CO2(g)与H2(g)为原料合成乙醇:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(l) ΔH
CH3CH2OH(g)+3H2O(l) ΔH
则:ΔH与ΔH1、ΔH2、ΔH3之间的关系是:ΔH=_______________________。
(2)一定条件下,H2、CO在体积固定的密闭容器中发生如下反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
下列措施中能够同时满足增大反应速率和提高CO转化率的是________(填字母)。
A.使用高效催化剂 B.降低反应温度
C.增大体系压强 D.不断将CH3OH从反应混合物中分离出来
(3)采用CO与H2反应合成再生能源甲醇,反应如下:
CO(g)+ 2H2(g)![]() CH3OH(g)
CH3OH(g)
在一容积可变的密闭容器中充有10molCO和20mol H2,在催化剂作用下发生反应生成甲醇。CO的平衡转化率(α)与温度(T)、压强(p)的关系如(图1)所示。
①合成甲醇的反应为______(填“放热”或“吸热”)反应。
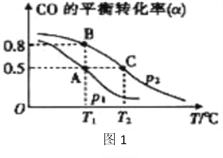
②A、B、C三点的平衡常数KA、KB、KC的大小关系为__________。
③若达到平衡状态A时,容器的体积为10L,则在平衡状态B时容器的体积为_______________L。
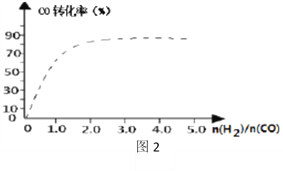
④(图2)中虚线为该反应在使用催化剂条件下关于起始氢气与CO投料比和CO平衡转化率的关系图。当其条件完全相同时,用实线画出不使用催化剂情况下CO平衡转化率的示意图.____________
【答案】 ΔH1 -2△H3-3△H2 C 放热 KA=KB>KC 2 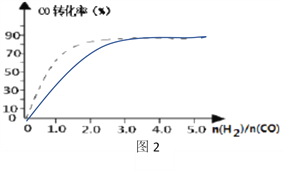
【解析】(1)已知:①2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)△H1,②H2O(1)═H2O(g)△H2,③CO(g)+H2O(g)CO2(g)+H2(g)△H3,根据盖斯定律,则①-②×3-③×2得2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O,则:△H=△H1-3△H2-2△H3,故答案为:△H1-3△H2-2△H3;
(2)A、使用高效催化剂只能增大反应速率,不能改变平衡移动,所以CO的转化率不变,故错误;B、降低反应温度会减慢反应速率,故错误;C、增大压强,反应速率增大,该反应属于气体体积减小的反应,增大压强,平衡向正反应方向移动,CO的转化率增大,故正确;D、不断将CH3OH从反应混合物中分离出来,即减小生成物的浓度,则反应速率减小,故错误;故答案为:C;
(3)①据图象可知,温度升高,CO的平衡转化率减小,平衡逆向移动,即逆反应方向为吸热,所以正反应方向为放热;故答案为:放热;
②因B点与A点温度相同,K不变,即KA=KB,该反应正反应属于放热反应,温度升高,平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC,故答案为:KA=KB>KC;
③T1时,A点对应的α=0.5,
CO(g)+2H2(g)CH3OH(g)
起始(mol) 10 20 0
转化(mol) 5 10 5
平衡(mol) 510 5
平衡常数K= =1,因B点与A点温度相同,K不变,B点对应的α=0.8,
=1,因B点与A点温度相同,K不变,B点对应的α=0.8,
CO(g)+2H2(g)CH3OH(g)
起始(mol) 10 20 0
转化(mol) 8 16 8
平衡(mol) 24 8
则K=![]() =
=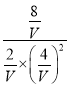 =1,解得:V=2L,故答案为:2;
=1,解得:V=2L,故答案为:2;
④使用催化剂,加快反应速率,达到平衡需要的时间减少,但是不会引起平衡的移动,当不使用催化剂,反应速率减慢,达到平衡需要的时间增大,但平衡状态相同,因此起始H2,CO投料比和CO平衡转化率的关系示意图如下: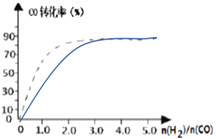 ,故答案为:
,故答案为: 。
。

 优学名师名题系列答案
优学名师名题系列答案
