题目内容
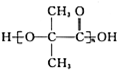
10.图中,a、b、c、d、e为元素周期表中前四周期的一部分元素,下列有关叙述正确的是( )| a | |||
| b | |||
| c | d | ||
| e |
| A. | 元素b位于ⅥA族,有+6、-2两种常见化合价 | |
| B. | 五种元素中,元素e的性质最稳定 | |
| C. | 原子半径有d>c>b | |
| D. | 元素e的化合物可能有剧毒 |
分析 a、b、c、d、e为元素周期表中前四周期的一部分元素,根据元素所在位置,可推知a为He、b为O、d为Cl、c为P、e为As.
A.氧元素没有+6价;
B.非金属性越强,氢化物越稳定;
C.同周期自左而右原子半径减小,电子层越多原子半径越大;
D.As的某些氧化物有毒.
解答 解:a、b、c、d、e为元素周期表中前四周期的一部分元素,根据元素所在位置,可推知a为He、b为O、d为Cl、c为P、e为As.
A.元素b为氧,位于ⅥA族,但氧元素没有+6价,故A错误;
B.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,五种元素中As的非金属性最弱,其氢化物最不稳定,故B错误;
C.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:c>d>b,故C错误;
D.As的氧化物如砒霜(As2O3)有剧毒,故D正确;
故选D.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素周期表与元素周期律、微粒半径比较及金属性、非金属性强弱比较为解答的关键,侧重对元素周期律的考查,题目难度不大.

练习册系列答案
相关题目
20.用坩埚钳夹住一小块刚用酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落.下列关于上述实验现象的解释不正确的是( )
| A. | 氧化铝未熔化 | B. | 铝在空气中能很快形成氧化膜 | ||
| C. | 氧化铝的熔点比铝高 | D. | 酒精灯温度低,铝未熔化 |
1.下列反应能说明卤素非金属性活泼顺序是Cl>Br>I的是( )
①2HClO4+Br2(气)═2HBrO4+Cl2?②2ΝαΒr+Cl2═2NaCl+Br2 ③2KI+Cl2═2KCl+I2 ④2KI+Br2═2KBr+I2.
①2HClO4+Br2(气)═2HBrO4+Cl2?②2ΝαΒr+Cl2═2NaCl+Br2 ③2KI+Cl2═2KCl+I2 ④2KI+Br2═2KBr+I2.
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
5.气体体积的大小,跟下列因素无关的是( )
| A. | 气体分子数目 | B. | 温度 | C. | 压强 | D. | 分子直径 |
15.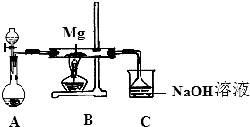 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
(1)选择制取SO2的合适试剂②③(填编号).
①浓HCl ②浓H2SO4 ③Na2SO3 固体 ④CaSO3 固体
(2)上述装置还可优化,优化的方法是在A和B之间未连接一干燥装置,装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境.
(3)甲同学推测Mg 与SO2的反应与CO2相似,则该反应方程式为2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S.
乙同学的推测是:2Mg+3SO2=2MgSO3+S;丙同学的推测是:3Mg+SO2=2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀.
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选.
根据上述实验探究,能证明甲同学推测正确的操作和预期现象是向反应后所得固体加过量2mol/L盐酸,固体未完全溶解且品红溶液不褪色(或反应后固体未完全溶解于盐酸且无气体产生).
(4)上述实验需要100mL,2mol/L 的HCl,配制时选用25mL(选填10mL、25mL、50mL 或100mL)量筒量取36.5%,密度1.19g/mL 的浓盐酸的体积为16.8mL.
 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.(1)选择制取SO2的合适试剂②③(填编号).
①浓HCl ②浓H2SO4 ③Na2SO3 固体 ④CaSO3 固体
(2)上述装置还可优化,优化的方法是在A和B之间未连接一干燥装置,装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境.
(3)甲同学推测Mg 与SO2的反应与CO2相似,则该反应方程式为2Mg+SO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+S.
乙同学的推测是:2Mg+3SO2=2MgSO3+S;丙同学的推测是:3Mg+SO2=2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀.
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/L NaOH、品红溶液、澄清石灰水、2mol/L CuSO4;仪器和用品自选.
| 序号 | 实验步骤 | 预期现象和结论 |
| 1 | 取少量反应后所得固体于试管中 | |
| 2 | 向试管中的固体慢慢滴加2mol/L 盐酸至过量,试管口塞上导管的单孔塞,并将导管通入盛有品红的试管中 | 若试管中的固体完全溶解,则丙同学推测正确.若试管中的固体未完全溶解,且品红溶液褪色,则乙同学推测正确. |
(4)上述实验需要100mL,2mol/L 的HCl,配制时选用25mL(选填10mL、25mL、50mL 或100mL)量筒量取36.5%,密度1.19g/mL 的浓盐酸的体积为16.8mL.
2.下列工业生产过程中涉及不到氧化还原反应的是( )
| A. | 接触法制硫酸 | B. | 侯德榜制纯碱 | ||
| C. | 粗铜精炼 | D. | 石油的裂化和裂解 |

 ,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯.
,G是一种高分子,可用于制造隐形眼镜的材料.H为六元环酯.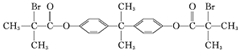 .
. .
. .
.