题目内容
某温度时,把1molN2O4气体通入体积为10L的真空容器,立即出现红棕色,反应进行4s时,NO2的浓度为0.04mol/L,再经过一段时间后,反应达平衡,这时容器内压强为开始时的1.8倍.则下列说法正确的是( )
分析:A.根据化学反应速率的定义可知,利用单位时间内浓度的变化量来计算化学反应速率;
B.利用一定条件下反应前后的物质的量之比等于压强之比来计算;
C.利用平衡时容器内压强为开始时的1.8倍来计算平衡时各物质的物质的量;
D.利用平衡时容器内压强为开始时的1.8倍来计算平衡时各物质的物质的量.
B.利用一定条件下反应前后的物质的量之比等于压强之比来计算;
C.利用平衡时容器内压强为开始时的1.8倍来计算平衡时各物质的物质的量;
D.利用平衡时容器内压强为开始时的1.8倍来计算平衡时各物质的物质的量.
解答:解:A、前4s中以NO2的浓度变化表示的平均反应速率为
=0.01mol/(L?s),则以N2O4的浓度变化表示的平均反应速率为0.005mol/(L?s),故A错误;
B、N2O4?2NO2
初始浓度:0.1 0
变化浓度:0.02 0.04
4s时浓度:0.08 0.04
在4S时容器内的压强和开始时的压强之比为:
=1.2,故B正确;
C、反应达平衡,这时容器内压强为开始时的1.8倍,设四氧化二氮的转化率为x,
N2O4?2NO2
初始浓度:0.1 0
变化浓度:x 2x
平衡浓度:0.1-x 2x
则
=1.8
解得 x=0.08,所以在平衡时容器内含N2O4物质的量为(0.1-0.08)×10mol=0.2mol,故C错误;
D、平衡时容器内含NO2物质的量为2×0.08×10mol=1.6mol,故D错误;
故选B.
| 0.04mol/L |
| 4s |
B、N2O4?2NO2
初始浓度:0.1 0
变化浓度:0.02 0.04
4s时浓度:0.08 0.04
在4S时容器内的压强和开始时的压强之比为:
| 0.08+0.04 |
| 0.1 |
C、反应达平衡,这时容器内压强为开始时的1.8倍,设四氧化二氮的转化率为x,
N2O4?2NO2
初始浓度:0.1 0
变化浓度:x 2x
平衡浓度:0.1-x 2x
则
| 0.1-x+2x |
| 0.1 |
解得 x=0.08,所以在平衡时容器内含N2O4物质的量为(0.1-0.08)×10mol=0.2mol,故C错误;
D、平衡时容器内含NO2物质的量为2×0.08×10mol=1.6mol,故D错误;
故选B.
点评:本题考查化学平衡及化学反应速率的计算,题目难度中等,明确信息中的压强关系及不同时间混合体系中各物质的物质的量的关系是解答的关键,并熟悉化学反应速率的计算式及影响化学平衡移动的因素即可解答.

练习册系列答案
相关题目
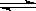 2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
2NO2,某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。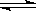 2NO2,某温度时,把1mol
N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。
2NO2,某温度时,把1mol
N2O4气体通入体积为10L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.8倍。