题目内容
3.下列物质属于同系物的是( )| A. | CH3CH2CH2OH 与CH3OH | B. |  与 与 | ||
| C. | 乙酸与HCOOCH3 | D. | CH3CH2Cl与CH3CH2CH2Br |
分析 结构相似,分子组成相差n个CH2原子团的有机化合物,互为同系物,注意同系物的官能团种类、数目相同.
解答 解:A.CH3CH2CH2OH 与CH3OH结构相似,分子组成相差2个CH2原子团的有机化合物,互为同系物,故A正确;
B.二者官能团不同,前者含有羧基,后者含有羟基,故B错误;
C.乙酸与HCOOCH3分子式相同,互为同分异构体,故C错误;
D.CH3CH2Cl与CH3CH2CH2Br官能团不同,前者含有氯原子,后者含有溴原子,故D错误.
故选A.
点评 本题考查有机物的官能团及同系物,注意同系物的官能团种类、数目相同为解答的难点,题目难度不大.

练习册系列答案
相关题目
13.一定条件下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0mol COCl2(g),经过一段时间后达到平衡.反应过程中测得的有关数据见下表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol•L-1,则反应的△H<0 | |
| B. | 若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 | |
| C. | 保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)>v(逆) | |
| D. | 保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |
11.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 乙烯和丙烯组成的42 g混合气体中氢原子的个数为6 NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 2 L0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA |
18.能正确表示下列反应的离子方程式是( )
| A. | 硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ | |
| B. | 碳酸钠溶液中加入澄清石灰水 Ca(OH)2+CO32-=CaCO3↓+2OH- | |
| C. | 冷的氢氧化钠溶液中通入氯气 Cl2+2OH-=ClO-+Cl-+H2O | |
| D. | 稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
8.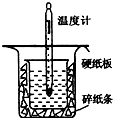 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒,除此之外,装置中的一个明显错误是大烧杯杯口与小烧杯杯口没有相平.
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于隔热,减少热量的损失.
(3)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),若实验操作均正确,则所求中和热相等填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:C. (从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:D. (从下列选出).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8kJ/mol( 取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc.
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒,除此之外,装置中的一个明显错误是大烧杯杯口与小烧杯杯口没有相平.
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于隔热,减少热量的损失.
(3)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),若实验操作均正确,则所求中和热相等填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:C. (从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:D. (从下列选出).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc.
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
15.0.5mol阿司匹林(学名为乙酰水杨酸,结构简式为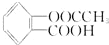 )与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
)与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
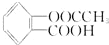 )与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )
)与足量的NaOH溶液反应,最多消耗NaOH的物质的量为( )| A. | 1.5mol | B. | 2 mol | C. | 1 mol | D. | 0.5 mol |

 ,则其单体的结构简式为CH≡CH.
,则其单体的结构简式为CH≡CH.