题目内容
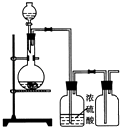
【题目】某课外活动小组利用高锰酸钾和浓盐酸来制取氯气,反应的化学方程式为
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.
(1)浓盐酸在此反应中显示出来的性质是 .
(2)若有15.9g的高锰酸钾与足量的浓盐酸反应,则被氧化的氯化氢的物质的量为 .
【答案】
(1)酸性和还原性
(2)0.5mol
【解析】解:(1)在反应2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,盐酸中的氯的化合价部分变,部分升高,所以盐酸具有酸性和还原性,所以答案是:酸性和还原性;(2)15.9gKMnO4的物质的量为 ![]() =0.1mol,则:
=0.1mol,则:
2KMnO4 | + | 16HCl | = | 2KCl | + | 2MnCl2 | + | 5Cl2↑ | + | 8H2O |
2 | 16 | 5 | ||||||||
0.1mol | n(HCl) | n(Cl2) |
所以,n(Cl2)= ![]() =0.25mol,被氧化的HCl生成氯气,故被氧化的HCl的物质的量为0.25mol×2=0.5mol,
=0.25mol,被氧化的HCl生成氯气,故被氧化的HCl的物质的量为0.25mol×2=0.5mol,
所以答案是:0.5mol.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目