题目内容
13.将20g 10%的NaOH溶液与30g 20%的NaOH溶液混合,混合溶液的密度为1.2g/cm3.试计算:(1)混合溶液中NaOH的质量分数
(2)混合溶液中NaOH的物质的量浓度.
分析 (1)计算混合后溶液的质量,混合后溶质的质量等于原不同浓度溶液中氢氧化钠的质量之和,结合m(溶质)=m(溶液)×ω(溶质)计算混合后溶质氢氧化质量分数;
(2)根据c=$\frac{1000ρω}{M}$计算混合后氢氧化钠的物质的量浓度.
解答 解:(1)将20g10%的NaOH溶液跟30g20%的NaOH溶液混合,混合后溶液的质量为20g+30g=50g,令混合后氢氧化钠的质量分数为ω,则:50g×ω=20g×10%+30g×20%,解得ω=16%,
答:混合溶液中NaOH的质量分数为16%;
(2)混合后溶液的密度为1.25g/mL,氢氧化钠的质量分数为20%,则c(NaOH)=$\frac{1000×1.2×16%}{40}$mol/L=4.8mol/L,
答:混合溶液中NaOH的物质的量浓度4.8mol/L.
点评 本题考查物质的量浓度有关计算,难度不大,注意理解掌握物质的量浓度与质量分数之间关系,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
3.下列对于“Na2O”的分类正确的是( )
| A. | 酸性氧化物 | B. | 有机物 | C. | 碱性氧化物 | D. | 混合物 |
4.下列说法不正确的是( )
| A. | 我国以三个强度等级(42.5、52.5、62.5)表示水泥的性能,等级越高性能越好 | |
| B. | 光导纤维的主要成分是石英玻璃 | |
| C. | 新型陶瓷分成两大类,即结构陶瓷(如纳米陶瓷)和功能陶瓷(如生物陶瓷) | |
| D. | 在玻璃中加入金属氧化物,可以使玻璃呈现颜色,例如加入氧化亚铜(Cu2O)呈蓝色 |
8.16g X气体含有3.01×1023个分子,则X的摩尔质量为( )
| A. | 16 g•mol-1 | B. | 32 g | C. | 32 g•mol-1 | D. | 64 g•mol-1 |
18.某有机物的结构简式如图.下列关于该有机物的叙述正确的是( )
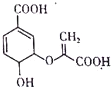

| A. | 分子中含有3种官能团 | |
| B. | 遇FeCl3溶液呈现为紫色 | |
| C. | 1mol该物质最多可与2molNaOH发生中和反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
2.用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75NA | |
| B. | 1.0L、1.0mol/L的Na2SiO3水溶液中含有的氧原子数为3NA | |
| C. | 0.1mol AlCl3完全转化为氢氧化铝胶体,生成0.lNA个胶体粒子 | |
| D. | 常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA |