题目内容
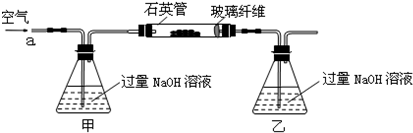
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)
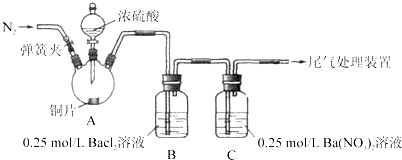
实验操作和现象:(BaCl2提示:A中产生的白雾,是H2SO4的酸雾)
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
(2)C中白色沉淀是______,该沉淀的生成表明SO2具有______性.
(3)C中液面上方生成浅棕色气体的化学方程式是______.
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应.
①为证实各自的观点,在原实验基础上:
甲在原有操作之前增加一步操作,该操作是______;
乙在A、B间增加洗气瓶D,D中盛放的试剂是足量饱和NaHSO3溶液.其目的是______.
②甲、乙分别进行实验,B中现象:
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
甲:______;乙:______.
(5)合并(4)中两同学的方案进行试验.B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是______.
解:(1)由现象可知,A中发生Cu与浓硫酸的反应,生成硫酸铜、二氧化硫和水,该反应为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)C中白色沉淀为硫酸钡,S元素的化合价升高,则体现SO2具有还原性,故答案为:BaSO4;还原;
(3)C中液面上方发生NO被氧化生成二氧化氮的反应,该反应为2NO+O2=2NO2,故答案为:2NO+O2=2NO2;
(4)①B中亚硫酸钡被空气中的氧气氧化,则为防止被氧化,应通N2一段时间,排除装置的空气,足量饱和NaHSO3溶液吸收H2SO4酸雾,
故答案为:通N2一段时间,排除装置的空气;吸收H2SO4酸雾;
②由白色沉淀,发现均不溶于稀盐酸,白色沉淀为硫酸钡,甲中发生SO42-+Ba2+=BaSO4↓,乙中发生2Ba2++2SO2+O2+2H2O=2BaSO4+4H+,
故答案为:SO42-+Ba2+=BaSO4↓;2Ba2++2SO2+O2+2H2O=2BaSO4+4H+;
(5)合并(4)中两同学的方案进行试验,得出的结论为SO2与可溶性钡的强酸盐不能反应(硝酸盐除外)生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应BaSO3沉淀,
故答案为:SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.
分析:(1)由现象可知,A中发生Cu与浓硫酸的反应,生成硫酸铜、二氧化硫和水;
(2)C中白色沉淀为硫酸钡,S元素的化合价升高;
(3)C中液面上方发生NO被氧化生成二氧化氮的反应;
(4)①B中亚硫酸钡被空气中的氧气氧化;硫酸酸雾能与B、C中钡离子反应;
②白色沉淀均不溶于盐酸,则白色沉淀为硫酸钡,以此分析发生的反应;
(5)SO2与可溶性钡的强酸盐不能反应,SO2与可溶性钡的弱酸盐能反应.
点评:本题考查实验方案的评价及性质实验方案的设计,题目难度较大,注意把握装置的作用及发生的反应是解答的关键,(4)、(5)为解答的难点.
 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;(2)C中白色沉淀为硫酸钡,S元素的化合价升高,则体现SO2具有还原性,故答案为:BaSO4;还原;
(3)C中液面上方发生NO被氧化生成二氧化氮的反应,该反应为2NO+O2=2NO2,故答案为:2NO+O2=2NO2;
(4)①B中亚硫酸钡被空气中的氧气氧化,则为防止被氧化,应通N2一段时间,排除装置的空气,足量饱和NaHSO3溶液吸收H2SO4酸雾,
故答案为:通N2一段时间,排除装置的空气;吸收H2SO4酸雾;
②由白色沉淀,发现均不溶于稀盐酸,白色沉淀为硫酸钡,甲中发生SO42-+Ba2+=BaSO4↓,乙中发生2Ba2++2SO2+O2+2H2O=2BaSO4+4H+,
故答案为:SO42-+Ba2+=BaSO4↓;2Ba2++2SO2+O2+2H2O=2BaSO4+4H+;
(5)合并(4)中两同学的方案进行试验,得出的结论为SO2与可溶性钡的强酸盐不能反应(硝酸盐除外)生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应BaSO3沉淀,
故答案为:SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀.
分析:(1)由现象可知,A中发生Cu与浓硫酸的反应,生成硫酸铜、二氧化硫和水;
(2)C中白色沉淀为硫酸钡,S元素的化合价升高;
(3)C中液面上方发生NO被氧化生成二氧化氮的反应;
(4)①B中亚硫酸钡被空气中的氧气氧化;硫酸酸雾能与B、C中钡离子反应;
②白色沉淀均不溶于盐酸,则白色沉淀为硫酸钡,以此分析发生的反应;
(5)SO2与可溶性钡的强酸盐不能反应,SO2与可溶性钡的弱酸盐能反应.
点评:本题考查实验方案的评价及性质实验方案的设计,题目难度较大,注意把握装置的作用及发生的反应是解答的关键,(4)、(5)为解答的难点.

练习册系列答案
相关题目
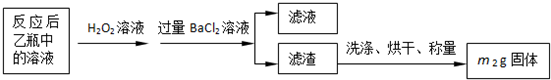
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料.某化学兴趣小组对该黄铁矿石进行如下实验探究.
将m1g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全.其反应的化学方程式为:
4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
4FeS+7O2 2Fe2O3+4SO2
2Fe2O3+4SO2
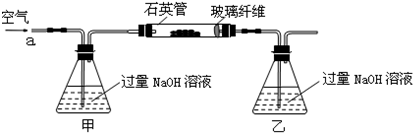
实验一:测定硫元素的含量
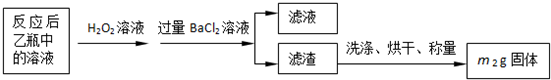
反应结束后,将乙瓶中的溶液进行如下处理:
(1)甲、乙两装置的作用分别是______、______;
乙瓶内发生反应的离子方程式为______、______;
(2)反应后乙瓶中的溶液需加足量H2O2溶液的目的是______.
(3)该黄铁矿石中硫元素的质量分数为______.
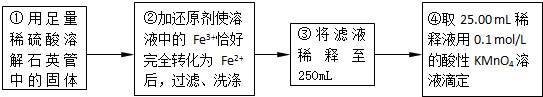
实验二:测定铁元素的含量
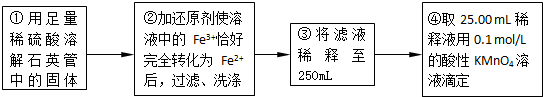
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量______(填“偏大”、“偏小”或“无影响”).
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有______.
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗KMnO4溶液体积/mL | 25.00 | 25.03 | 24.97 |
(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下(所取溶液体积均为10mL):
其他条件不变时:探究浓度对化学反应速率的影响,应选择______(填实验编号);
探究温度对化学反应速率的影响,应选择______(填实验编号).
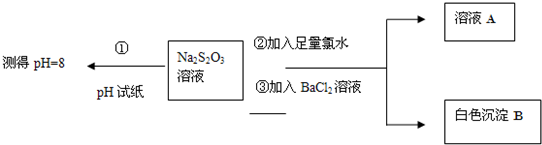
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是______.
甲同学设计如下实验流程探究Na2S2O3的化学性质.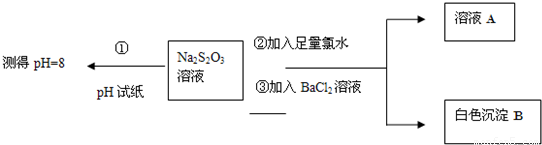
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和______性.
(Ⅱ)生成白色沉淀B的离子方程式是______.
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是______(填“甲”或“乙”),理由是______.
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
探究温度对化学反应速率的影响,应选择______(填实验编号).
(2)已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8mol电子.该反应的离子方程式是______.
甲同学设计如下实验流程探究Na2S2O3的化学性质.

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和______性.
(Ⅱ)生成白色沉淀B的离子方程式是______.
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是______(填“甲”或“乙”),理由是______.