题目内容
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。实验室由铬铁矿粉制备重酪酸流程如图所示:

已知步骤①的主要反应为:
![]()
(未配平)。有关物质的溶解度如图所示。

回答下列问题:
(1)滤渣2的主要成分是_________及含硅杂质。
(2)步骤④调滤液2的pH最合适的试剂是______________。
A.H2SO4溶液 B.KOH溶液 C.浓盐酸 D.K2CO3粉末
如何最简单的方法粗略判断pH已调至合适范围_________________。
(3)向“滤液3”中加入适量KCl,蒸发浓缩至_____________________,停止加热,然后冷却结晶,得到的K2Cr2O7固体产品。
(4)本实验过程中多次用到抽滤的装置,下列关于抽滤的说法正确的是_______。
A.抽滤时,先用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
B.右图抽滤装置中只有2处错误
C.抽滤得到的滤液应从吸滤瓶的支管口倒出
D.洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀,减小沉淀的损失。
(5)某同学用mg铬铁矿粉(含Cr2O3 40%)制备K2C r2O7,为了测定产率,该同学设计了以下实验:将所有产品加水溶解并定容于500mL容量瓶中,移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加入过量2mol·L-1H2SO4,再加1.1KI,加塞摇匀,充分反应后铬完全以Cr3+存在,于暗处静置5min后,加指示剂,用0.0250mol·L-1标准Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液20.00mL。(已知:2 Na2S2O3+I2=Na2S4O6+2NaI)若滴定时振荡不充分,刚看到局部变色就停止滴定,则会使产量的测量结果__________(填“偏高”“偏低”或“无影响”)。计算该同学的产量_____________x100%(用含是m的式子表示,要求化简,m的系数保留两位小数)
【答案】 Al(OH)3 A 溶液的颜色显橙红色,继续滴加酸后颜色没有明显变化 表面出现晶膜 AB 偏低 0.63/m
【解析】铬铁矿的主要成分为FeOCr2O3,还含有硅、铝等杂质,制备重铬酸钾,由制备流程可知,步骤①的主要反应为FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,由电子、原子守恒可知,反应为2FeOCr2O3+4Na2CO3+7NaNO3
Na2CrO4+Fe2O3+CO2+NaNO2,Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,由电子、原子守恒可知,反应为2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2,该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3,滤液1中含NaAlO2、Na2CrO4,调节pH过滤分离出Al(OH)3、Si,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7;
4Na2CrO4+Fe2O3+4CO2+7NaNO2,该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3,滤液1中含NaAlO2、Na2CrO4,调节pH过滤分离出Al(OH)3、Si,滤液2中含Na2CrO4,④中调节pH发生2CrO42-+2H+Cr2O72-+H2O,滤液3含Na2Cr2O7,由水中的溶解度:Na2Cr2O7>K2Cr2O7,可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7;
(1)由上述分析可知,滤渣2的主要成分是Al(OH)3及含硅杂质;
(2))步骤④中调节pH发生2CrO42-+2H+![]() Cr2O72-+H2O,则需要滴加稀酸溶液促进平衡正向移动,而Cl-在酸性条件下能被Cr2O72-氧化,则应选择稀硫酸,答案为A;当溶液的颜色显橙红色,继续滴加酸后颜色没有明显变化,说明pH已调至合适范围;
Cr2O72-+H2O,则需要滴加稀酸溶液促进平衡正向移动,而Cl-在酸性条件下能被Cr2O72-氧化,则应选择稀硫酸,答案为A;当溶液的颜色显橙红色,继续滴加酸后颜色没有明显变化,说明pH已调至合适范围;
(3)“滤液3”中加入适量KCl,当蒸发浓缩至溶液表面出现晶膜时,停止加热,再冷却结晶,得到K2Cr2O7;
(4)A.向布氏漏斗中转移混合物时应先用倾析法转移溶液,然后开大水龙头,使吸滤瓶中气压减小,加快过滤的速度,待溶液快流尽时再转移沉淀,故B正确;B.装置中布氏漏斗下端不能与支管口在同一水面内,另外抽滤瓶导管伸入瓶内部分,是左短右长,则共有2处错,故B正确;C.抽滤得到的滤液应从吸滤瓶瓶口倒出,故C错误;D.洗涤沉淀时,应开小水龙头,使洗涤剂缓慢通过沉淀,以减小沉淀的损失,故D错误;答案为AB;
(5)根据Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O和2Na2S2O3+I2 == Na2S4O6+2NaI,得关系式:Cr2O72-~~~3I2~~~6Na2S2O3,则样品中K2Cr2O7的物质的量为0.0250mol·L–1×0.02L×![]() ×
×![]() =
=![]() mol,m g铬铁矿粉(含Cr2O3 40%)理论制得K2Cr2O7的物质的量为
mol,m g铬铁矿粉(含Cr2O3 40%)理论制得K2Cr2O7的物质的量为![]() ×2÷2=
×2÷2=![]() mol,则产率为
mol,则产率为![]() =
=![]() 。
。

【题目】对甲基苯胺可用对硝基甲苯在酸性条件下用铁粉还原制得:

主要反应物和产物的物理性质见下表:
化合物 | 物质状态 | 溶解性 | 熔点(℃) | 沸点(℃) | 密度(g·cm-3) |
对硝基甲苯 | 浅黄色晶体 | 不溶于水,溶于乙醇、苯 | 51.4 | 237.7 | 1.286 |
对甲基苯胺 | 白色片状晶体 | 微溶于水,易溶于乙醇、苯 | 43~45 | 200~202 | 1.046 |
对甲基苯胺盐酸盐 | 白色晶体 | 易溶于水,不溶于乙醇、苯 | 243~245 | —— | —— |
苯 | 无色液体 | 不溶于水,溶于乙醇 | 5.5 | 80.1 | 0.874 |
实验流程如下:

请回答下列问题:
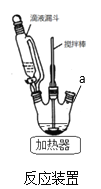
(1)反应装置如图,a处缺少一装置_____________(填仪器名称)
(2)步骤②中加苯的作用是_____________,步骤②中用5%碳酸钠溶液调pH=7~8的原因_________
(3)步骤③得到的固体物质为_________
(4)步骤④中加入盐酸的作用是_____________
(5)步骤⑤中通过加入氢氧化钠溶液使对甲基苯胺结晶析出的原理为_____________
(6
A. 蒸馏水 B.乙醇 C.NaOH溶液 D.HCl溶液
【题目】在某温度T℃时,将N2O4、NO2分别充入两个各为1L的密闭容器中,反应过程中浓度变化如下[2NO2(g)![]() N2O4(g) △H<0]:
N2O4(g) △H<0]:
容器 | 物质 | 起始浓度/(mol | 平衡浓度/(mol |
Ⅰ | N2O4 | 0.100 | 0.040 |
NO2 | 0 | 0.120 | |
Ⅱ | N2O4 | 0 | 0.0142 |
NO2 | 0.100 | 0.0716 |
下列说法不正确的是( )
A. 平衡时,Ⅰ、Ⅱ中反应的转化率a(N2O4)>a(NO2)
B. 平衡后,升高相同温度,以N2O4表示的反应速率v(Ⅰ)<v(Ⅱ)
C. 平衡时,Ⅰ、Ⅱ中正反应的平衡常数K(I)=![]()
D. 平衡后,升高温度,Ⅰ、Ⅱ中气体颜色都将变深
【题目】I.某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定装置如图

(1)图中A的名称是:_____________________________
(2)若实验过程中酸碱添加过慢,所得△H将________(填:偏大、偏小或者无影响)
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.2 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.4 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.4 | 26.2 | 26.3 | 30.4 |
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=_____________(取小数点后一位).
II.为了研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间。

(4)请完成此实验设计,其中:V6=________,V8=___________
(5)该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,请分析主要原因________________________。
III.利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取xmL一定物质的量浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂
步骤Ⅱ:移取ymL BaCl2溶液于锥形瓶中,加入xmL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用bmol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
(6)BaCl2溶液的浓度为___________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量盐酸滴至锥形瓶外,Ba2+浓度测量值将______________(填“偏大”或“偏小”)。
