题目内容
NaHCO3和Na2O2按1:1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是( )
| A、Na2O2和NaHCO3 |
| B、NaHCO3和Na2CO3 |
| C、NaOH和Na2CO3 |
| D、只有Na2CO3 |
考点:钠的重要化合物,有关混合物反应的计算
专题:几种重要的金属及其化合物
分析:Na2O2与等物质的量的NaHCO3混合后,在密闭容器中充分加热,可能发生的反应有:2NaHCO3
Na2CO3+CO2↑+H2O,
2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,根据二者的物质的量的关系来判断残留固体.
| ||
2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,CO2+2NaOH=Na2CO3+H2O,根据二者的物质的量的关系来判断残留固体.
解答:
解:设Na2O2固体和NaHCO3固体都为1mol,
则2NaHCO3
Na2CO3+CO2↑+H2O
2mol 1mol 1mol 1mol
1mol 0.5mol 0.5mol 0.5mol
2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,
0.5mol 0.5mol 0.5mol 0.5mol 0.5mol 1mol
则剩余固体为n(Na2CO3)=0.5mol+0.5mol=1mol,
n(NaOH)=1mol,
即剩余固体是等物质的量的Na2CO3和 NaOH的混合物,
故选C.
则2NaHCO3
| ||
2mol 1mol 1mol 1mol
1mol 0.5mol 0.5mol 0.5mol
2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,
0.5mol 0.5mol 0.5mol 0.5mol 0.5mol 1mol
则剩余固体为n(Na2CO3)=0.5mol+0.5mol=1mol,
n(NaOH)=1mol,
即剩余固体是等物质的量的Na2CO3和 NaOH的混合物,
故选C.
点评:本题考查钠的化合物的性质,题目难度不大,本题注意等物质的量的NaHCO3和Na2O2固体混合物的特点,注意有关反应,以正确判断最终产物.

练习册系列答案
相关题目
同温同压下,在等质量的二氧化硫气体和二氧化碳气体的比较中,正确的是( )
| A、密度比为11:16 |
| B、物质的量比为16:11 |
| C、体积比为11:16 |
| D、分子个数比为16:11 |
电解CuCl2和NaCl的混合溶液,阴极和阳极上最先分别析出的物质是( )
| A、H2和Cl2 |
| B、Cu和Cl2 |
| C、H2和O2 |
| D、Cu和O2 |
在下列条件下,一定能大量共存的离子组是( )
| A、水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I- |
| B、强酸性溶液中:Al3+、K+、Mg2+、Cl-、SO42- |
| C、c(Fe3+)=0.1mol?L-1的溶液中:Na+、SCN-、Cl-、Br- |
| D、强碱性溶液中:ClO-、SO42-、SO32-、Na+ |
有机物的分子中,当它含有下列的一种官能团时,既能发生取代反应,氧化反应,酯化反应,又能发生消去反应的是( )
| A、-COOH |
B、 |
| C、-OH |
D、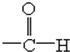 |
实验室中需用480mL 0.2mol/L的Na2CO3溶液,配制时需要无水Na2CO3的质量是( )
| A、10.60g |
| B、10.18g |
| C、21.2g |
| D、5.30g |
当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A、矿泉水 |
| B、稀HCl |
| C、FeCl3溶液 |
| D、Fe(OH)3胶体 |
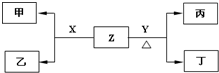 A、B、C三种短周期元素在周期表中相对位置如表格:
A、B、C三种短周期元素在周期表中相对位置如表格: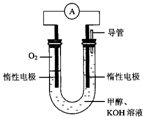 某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.
某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置.