题目内容
 某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
某短周期主族元素的原子最外层电子数为次外层的2倍,其单质甲可发生如下反应:
甲+乙 丙+丁+水.
丙+丁+水.
(1)若丙为NO2.
①甲与乙反应的化学方程式为______.
②NO2可作火箭重要燃料-肼(N2H4)的助燃剂.已知:
N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1,
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1.
写出燃料-肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:______.
(2)若丙为SO2.
①把乙滴入硫酸铜晶体,观察到的现象是______.
②SO2能使酸性KMnO4溶液紫红色褪去,完成下列离子方程式:
 MnO4-+
MnO4-+ SO2+
SO2+ ______=
______= Mn2++
Mn2++ SO42-+
SO42-+ H+
H+
③SO2在一定条件下,发生:2SO2(g)+O2(g)?2SO3(g)△H<0反应.
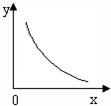
该反应的化学平衡常数K=______(填表达式);反应达平衡时,若改变其中一个条件x,则符合图中曲线的是______(填序号).
a.x表示温度,y表示SO2的物质的量
b.x表示压强,y表示SO2的转化率
c.x表示SO2的物质的量,y表示O2的物质的量
d.x表示SO3的物质的量,y表示化学平衡常数K.
 丙+丁+水,故乙含有H元素、O元素;
丙+丁+水,故乙含有H元素、O元素;(1)若丙为NO2,由转化关系可知,乙为HNO3,丁为CO2;
①碳与浓硝酸反应生成二氧化碳、二氧化氮、水,反应方程式为:C+4HNO3(浓)
 CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;故答案为:C+4HNO3(浓)
 CO2↑+4NO2↑+2H2O;
CO2↑+4NO2↑+2H2O;②已知:Ⅰ、N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ?mol-1,
Ⅱ、2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7kJ?mol-1.
根据盖斯定律,Ⅰ+Ⅱ得2N2H4(g)+2O2(g)=2N2(g)+4H2O(g)△H=-1068kJ?mol-1;
即N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1;
故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ?mol-1;
(2)若丙为SO2,由转化关系可知,乙为H2SO4,丁为CO2;
①把硫酸滴入硫酸铜晶体中,浓硫酸具有吸水性,蓝色晶体变白色;
故答案为:蓝色晶体变白色;
②反应中MnO4-→Mn2+,Mn元素化合价由+7降低为+2,总共降低5价,SO2→SO42-,S元素化合价由+4升高为+6,总共升高2价,化合价升降最小公倍数为10,故MnO4-系数为2,故SO2系数为5,根据元素守恒故Mn2+系数为2,故SO42-系数为5,由电荷守恒故H+系数为4,根据元素守恒可知缺项为H2O,故H2O系数为2,配平后为:②2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;
故答案为:2、5、2H2O、2、5、4;
③平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,故可逆反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=
 ;
;由图象可知,随x的增大y值降低,
a.该反应为放热反应,升高温度平衡向逆反应反应,SO2的物质的量增大,图象与实际不相符,故a错误;
b.反应为气体物质的量减小的反应,增大压强平衡向正反应移动,SO2的转化率增大,图象与实际不相符,故b错误;
c.增大SO2的物质的量,平衡向正反应移动,O2的物质的量减小,图象与实际相符合,故c正确;
d.化学平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变,图象与实际不相符,故d错误;
故答案为:
 ;c.
;c.分析:短周期主族元素的原子最外层电子数为次外层的2倍,该原子有2个电子层,最外层电子数为4,为C元素,其单质甲为C单质,可以发生:甲+乙
 丙+丁+水,故乙含有H元素、O元素;
丙+丁+水,故乙含有H元素、O元素;(1)若丙为NO2,由转化关系可知,乙为HNO3,丁为CO2;
①碳与浓硝酸反应生成二氧化碳、二氧化氮、水;
②根据盖斯定律构造目标方程式;
(2)若丙为SO2,由转化关系可知,乙为H2SO4,丁为CO2;
①浓硫酸具有吸水性;
②根据化合价升降相等,利用最小公倍数配平,根据元素守恒判断缺项物质;
③平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
由图象可知,随x的增大y值降低,结合选项判断平衡移动进行解答:
a.该反应为放热反应,升高温度平衡向逆反应反应,SO2的物质的量增大;
b.反应为气体物质的量减小的反应,增大压强平衡向正反应移动,SO2的转化率增大;
c.增大SO2的物质的量,平衡向正反应移动,O2的物质的量减小;
d.化学平衡常数只受温度影响,与浓度无关,温度不变,平衡常数不变.
点评:本题以物质转化关系的形式考查N、S等元素单质及其化合物之间的相互转化关系、热化学方程式等化学用语的书写、氧化还原反应配平、平衡常数与平衡移动等,难度不大,注意基础知识的掌握.

| 元素编号 | 元素性质与原子(分子)结构 |
| A | 族序数等于周期数3倍的元素 |
| B | 周期数等于族序数3倍的元素 |
| C | 常温下气体单质为双原子分子.C的气态氢化物能使酚酞溶液变红色 |
| D | 第三周期金属元素,能和B的最高价氧化物对应的水化物反应生成氢气 |
(2)元素B和D相比,金属性较强的是______(填元素符号),可以验证该结论的实验是______.
①比较两种元素的单质的密度
②将这两种元素的单质粉末分别和同浓度的盐酸反应
③将在空气中放置已久的这两种元素的块状单质分别放入热水中
④比较这两种元素的气态氢化物的稳定性
(3)元素B和A能形成化合物B2A2,将10g含有CO2和CO的混合气体,通入装有足量B2A2的干燥管,反应后干燥管的总质量增加5.6g,则原混合气体中的CO2质量分数为______
(4)向某无色透明的溶液中加入D的粉末,反应后只生成氢气.下列各组离子在该溶液中一定可以大量共存的是______
A.K+ Na+ Cl- SO42- B.Na+ Cl- SO42- HCO3-
C.Na+ CO3- NO3- K+ D.Al3+ NH4+ Cl- SO42-.
现有部分短周期主族元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(分子)结构 |
| A | 族序数等于周期数3倍的元素 |
| B | 周期数等于族序数3倍的元素 |
| C | 常温下气体单质为双原子分子。C的气态氢化物能使酚酞溶液变红色 |
| D | 第三周期金属元素,能和B的最高价氧化物对应的水化物反应生成氢气 |
(1)写出元素C的原子结构示意图
(2)元素B和D相比,金属性较强的是 (填元素符号),可以验证该结论的实验是 。
①比较两种元素的单质的密度
②将这两种元素的单质粉末分别和同浓度的盐酸反应
③将在空气中放置已久的这两种元素的块状单质分别放入热水中
④比较这两种元素的气态氢化物的稳定性
(3)元素B和A能形成化合物B2A2,将10g含有CO2和CO的混合气体 ,通入装有足量B2A2的干燥管,反应后干燥管的总质量增加5.6g,则原混合气体中的CO2质量分数为
(4)向某无色透明的溶液中加入D的粉末,反应后只生成氢气。下列各组离子在该溶液中
一定可以大量共存的是
A.K+ Na+ Cl- SO42- B.Na+ Cl- SO42- HCO3-
C.Na+ CO3- NO3- K+ D.Al3+ NH4+ Cl- SO42-
现有部分短周期主族元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(分子)结构 |
| A | 族序数等于周期数3倍的元素 |
| B | 周期数等于族序数3倍的元素 |
| C | 常温下气体单质为双原子分子。C的气态氢化物能使酚酞溶液变红色 |
| D | 第三周期金属元素,能和B的最高价氧化物对应的水化物反应生成氢气 |
(1)写出元素C的原子结构示意图
(2)元素B和D相比,金属性较强的是 (填元素符号),可以验证该结论的实验是 。
①比较两种元素的单质的密度
②将这两种元素的单质粉末分别和同浓度的盐酸反应
③将在空气中放置已久的这两种元素的块状单质分别放入热水中
④比较这两种元素的气态氢化物的稳定性
(3)元素B和A能形成化合物B2A2,将10g含有CO2和CO的混合气体 ,通入装有足量B2A2的干燥管,反应后干燥管的总质量增加5.6g,则原混合气体中的CO2质量分数为
(4)向某无色透明的溶液中加入D的粉末,反应后只生成氢气。下列各组离子在该溶液中一定可以大量共存的是
A.K+ Na+ Cl- SO42- B.Na+ Cl- SO42- HCO3-
C.Na+ CO3- NO3- K+ D.Al3+ NH4+ Cl- SO42-
