题目内容
A、B、C、D、E、F为原子序数依次增大的同 一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E。G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E。G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
(1)写出E元素在元素周期表中的位置为
(2)D的原子结构示意图为
(3)用电子式表示出B、F形成化合物的电子式
(4)以上元素中原子半径最大的是 金属性最强的元素是 (均用元素名称回答)
(5)实验室制备G的氢化物的化学方程式:

(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1—2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是
②相应的化学方程式:
 一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E。G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:
一短周期的主族元素,已知A、C、F三种元素原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应生成盐和水,D元素原子次外层电子数是最外层电子数的2倍,E的气态氢化物的化学式为H2E。G元素是与以上元素既不在同一周期也不在同一主族的短周期主族元素,请回答:(1)写出E元素在元素周期表中的位置为
(2)D的原子结构示意图为
(3)用电子式表示出B、F形成化合物的电子式
(4)以上元素中原子半径最大的是 金属性最强的元素是 (均用元素名称回答)
(5)实验室制备G的氢化物的化学方程式:

(6)如果向D的最高价氧化物对应水化物的钠盐溶液中滴入1—2滴酚酞,再逐滴滴入稀盐酸 ①这个过程中相应的现象是
②相应的化学方程式:
(1)第三周期第VIA族 (1分)(全对得1分)
(2)
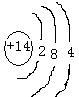 (1分)
(1分)
(3) (2分)(无弧形箭头的不扣分)(4) 钠(1分)、钠(1分)
(2分)(无弧形箭头的不扣分)(4) 钠(1分)、钠(1分)
 (5)2NH4Cl+Ca(OH)2
(5)2NH4Cl+Ca(OH)2
 2NH3 +CaCl2 + 2H2O(2分)
2NH3 +CaCl2 + 2H2O(2分)
(6)
(2)

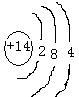 (1分)
(1分)(3)
 (2分)(无弧形箭头的不扣分)(4) 钠(1分)、钠(1分)
(2分)(无弧形箭头的不扣分)(4) 钠(1分)、钠(1分) 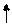 (5)2NH4Cl+Ca(OH)2
(5)2NH4Cl+Ca(OH)2
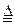 2NH3 +CaCl2 + 2H2O(2分)
2NH3 +CaCl2 + 2H2O(2分)(6)
| 现象 | ①滴入酚酞溶液显红色,再滴入盐酸红色逐渐消失,并有透明胶状物质生成 每个现象1分 ,共3分 (出现关键字即得分 ) ,共3分 (出现关键字即得分 ) |
| 化学方程式 | ②Na2SiO3+2HCl==H2SiO3(胶体)+2NaCl(2分)(不写“胶体”扣1分) |
略

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
 、SCN-、Cl-
、SCN-、Cl- 、SO
、SO