题目内容
(2012?浙江模拟)下列有关实验说法不正确的是( )
分析:A.锌和铁在酸性条件下可形成原电池反应;
B.火柴头中含有KClO3,ClO3-+3NO2-+Ag+═AgCl↓+3NO3-,出现白色沉淀,证明含有氯元素;
C.蒸发皿中蒸发浓缩溶液表面出现结晶薄膜为止,放置冷却,得(NH4)2SO4?FeSO4?6H2O晶体;
D.氯乙烷在碱性条件下水解生成乙醇和HCl,可用硝酸酸化,然后加入硝酸银检验.
B.火柴头中含有KClO3,ClO3-+3NO2-+Ag+═AgCl↓+3NO3-,出现白色沉淀,证明含有氯元素;
C.蒸发皿中蒸发浓缩溶液表面出现结晶薄膜为止,放置冷却,得(NH4)2SO4?FeSO4?6H2O晶体;
D.氯乙烷在碱性条件下水解生成乙醇和HCl,可用硝酸酸化,然后加入硝酸银检验.
解答:解:A.电化学反应较化学反应快,锌和铁在酸性条件下可形成原电池反应,反应速率较快,可用于判断,故A正确;
B.火柴头中含有KClO3,检验氯元素,应把ClO3-还原为4Cl-,酸性条件下,NO2-具有还原性,向少量的火柴头浸泡液中滴加AgNO3、稀HNO3和NaNO2,发生的离子反应为:ClO3-+3NO2-+Ag+═AgCl↓+3NO3-,出现白色沉淀,证明含有氯元素,故B正确;
C.将蒸发皿置于水浴上蒸发、浓缩至表面出现结晶薄膜为止,放置冷却,得(NH4)2SO4?FeSO4?6H2O晶体,不能将溶液全部蒸干,以防温度过高导致(NH4)2SO4?FeSO4?6H2O分解,故C正确;
D.用稀硫酸进行酸化,可生成微溶于水的硫酸银沉淀,影响实验结论,应用硝酸酸化,故D错误.
故选D.
B.火柴头中含有KClO3,检验氯元素,应把ClO3-还原为4Cl-,酸性条件下,NO2-具有还原性,向少量的火柴头浸泡液中滴加AgNO3、稀HNO3和NaNO2,发生的离子反应为:ClO3-+3NO2-+Ag+═AgCl↓+3NO3-,出现白色沉淀,证明含有氯元素,故B正确;
C.将蒸发皿置于水浴上蒸发、浓缩至表面出现结晶薄膜为止,放置冷却,得(NH4)2SO4?FeSO4?6H2O晶体,不能将溶液全部蒸干,以防温度过高导致(NH4)2SO4?FeSO4?6H2O分解,故C正确;
D.用稀硫酸进行酸化,可生成微溶于水的硫酸银沉淀,影响实验结论,应用硝酸酸化,故D错误.
故选D.
点评:本题考查化学实验基本操作问题,题目难度中等,本题注意把握相关物质的性质,为解答该题的关键.

练习册系列答案
相关题目
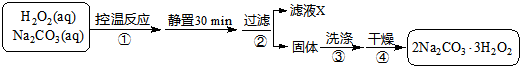
 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)