题目内容
下列化学过程及其表述正确的是
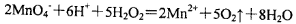
A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性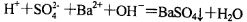 |
B.由水电离的c(H+)为l0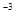 mol mol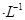 的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存 的溶液中,Na+、NO3-、SO32-、Cl-定能大量共存 |
| C.酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,导致计算结果偏低 |
| D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性 |
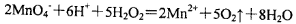
C
试题分析:A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性,反应的离子方程式是:2H++ SO42-+ Ba2++2OH-==BaSO4↓+2H2O。错误。B.由水电离的c(H+)为l0-3 mol/L的溶液,水的电离受到了促进。可能是强酸弱碱盐,也可能是强碱弱酸盐溶液。在强酸弱碱盐溶液中SO32-不能大量共存。错误。C.酸碱中和滴定时,盛装标准液的滴定管滴定前无气泡,终点读数时有气泡,消耗的标准溶液体积读数偏小,以此为标准计算的碱溶液的浓度就偏低。正确。D.由于浓盐酸有还原性,所以酸化高锰酸钾溶液要用硫酸来酸化,然后溶液与H2O2混合,以证明H2O2具有还原性。错误。

练习册系列答案
相关题目