题目内容
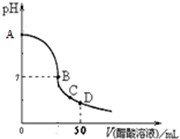
向25.00mL 0.1000mol/L NaOH溶液中逐滴加入0.1000mol/L CH3COOH溶液,溶液pH变化曲线如图所示,下列有关判断错误的是( )
A.在A点,溶液的pH=13
B.在B点,c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点,c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.在D点,c(CH3COO-)+c(CH3COOH)=2c(Na+)
【答案】分析:A.NaOH为强碱,根据c(OH-)计算pH;
B.B点溶液呈中性,结合电荷守恒判断;
C.阳离子浓度大于阴离子浓度,溶液电荷不守恒;
D.结合物料守恒判断.
解答:解:A.NaOH为强碱,0.1000mol/L NaOH溶液中c(OH-)=0.1000mol/L,则pH=13,故A正确;
B.B点溶液呈中性,因c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(OH-)=c(H+),则c(Na+)=c(CH3COO-),故B正确;
C.C点溶液呈酸性,应存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.D点,加入醋酸的物质的量为NaOH的物质的量的2倍,根据物料守恒可知c(CH3COO-)+c(CH3COOH)=2c(Na+),故D正确.
故选C.
点评:本题考查酸碱混合的定性判断和计算问题,题目难度不大,注意把握图象各点酸碱物质的量的关系,结合电荷守恒和物料守恒解答该题.
B.B点溶液呈中性,结合电荷守恒判断;
C.阳离子浓度大于阴离子浓度,溶液电荷不守恒;
D.结合物料守恒判断.
解答:解:A.NaOH为强碱,0.1000mol/L NaOH溶液中c(OH-)=0.1000mol/L,则pH=13,故A正确;
B.B点溶液呈中性,因c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(OH-)=c(H+),则c(Na+)=c(CH3COO-),故B正确;
C.C点溶液呈酸性,应存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C错误;
D.D点,加入醋酸的物质的量为NaOH的物质的量的2倍,根据物料守恒可知c(CH3COO-)+c(CH3COOH)=2c(Na+),故D正确.
故选C.
点评:本题考查酸碱混合的定性判断和计算问题,题目难度不大,注意把握图象各点酸碱物质的量的关系,结合电荷守恒和物料守恒解答该题.

练习册系列答案
相关题目
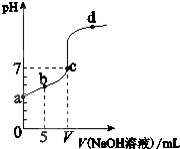 (2011?东莞模拟)在25℃下,向10.00mL 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH 溶液,溶液pH变化曲线如右图所示.下列说法正确的是( )
(2011?东莞模拟)在25℃下,向10.00mL 0.01mol/L某一元酸HA溶液中逐滴加入0.01mol/L NaOH 溶液,溶液pH变化曲线如右图所示.下列说法正确的是( ) (相对分子质量为180).
(相对分子质量为180).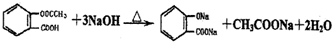
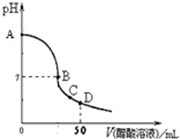 (2010?宣武区二模)向25.00mL 0.1000mol/L NaOH溶液中逐滴加入0.1000mol/L CH3COOH溶液,溶液pH变化曲线如图所示,下列有关判断错误的是( )
(2010?宣武区二模)向25.00mL 0.1000mol/L NaOH溶液中逐滴加入0.1000mol/L CH3COOH溶液,溶液pH变化曲线如图所示,下列有关判断错误的是( )