��Ŀ����
����Ŀ��I .����ͼװ�ý���ʵ�飬���ش��������⣺

��1��п��Ϊ_____�����缫��ӦʽΪ_____________��
��2��ʯī��C1Ϊ____�����缫��ӦʽΪ____________��ʯī��C2����������ʵ������Ϊ___________��
��3����C2������224mL���壨��״̬��ʱ��п����������____g����ʱװ��B��OH-�����ʵ���Ϊ____mol��
II. ��1���繤����˵��һ���ͷ����ͭ������Ϲ��Ū�������Ե繤�����Ϲ涨���ܰ�ͭ������������������һ��ʹ�ã�˵��ԭ��:________________��
��2��������ԭ���ԭ�����ʵ�飬��֤Cu2+��Fe3+�����Ե�ǿ������д���缫��Ӧʽ������_______������___________��
��3�����ڷ����ڻ���ʵ��װ��ͼ����������·��������
______
���𰸡� ���� Zn-2e- = Zn2+ ���� 2C1--2e-=C12�� �������������Һ���ɫ 0.65 0.02 ͭ�������ӻṹ��ԭ��أ�������Ϊԭ��صĸ�����ͭΪԭ��ص�����������ԭ��غ����ĸ�ʴ�ٶȴ��ӿ죬�������������࣬ʱ�䳤�ˣ��п����������֡� Cu-2e- = Cu2+ �������10��2Fe3++ 2e- =2Fe2+ 
������������(1)ԭ����л��ý���п������������ʧ���ӵ�������Ӧ����Zn-2e-=Zn2+���ʴ�Ϊ������Zn-2e-=Zn2+��
(2)ʯī��C1��ԭ��ص���������������������������Ӧ���缫��ӦʽΪ2Cl--2e-=Cl2����ʯī��C2�������������ӷŵ�������������Һ�ʼ��ԣ�������̪��죬�ʴ�Ϊ��������2Cl--2e-=Cl2�����������������Һ���ɫ��
(3)C2�������ĵ缫��ӦΪ��2H++2e-��H2��������224mL(��0.01mol)����(��״̬)ʱ��ת�Ƶ�������0.02mol������п��ת�Ƶ���ҲΪ0.02mol������Zn-2e-=Zn2+��п��ת�Ƶ���Ϊ0.02molʱ������0.01mol����п���٣���п����������0.65g��ͬʱ��B����C2����0.02mol�������ӷŵ磬ͬʱ����0.02molOH-���ʴ�Ϊ��0.65��0.02��
����(1)ͭ�����������ã��������Ǹ�����ͭ������������ԭ��ؼ������ĸ�ʴ���������������࣬ʱ�䳤�ˣ��п����������֣��ʴ�Ϊ��ͭ�������ӻṹ��ԭ��أ�������Ϊԭ��صĸ�����ͭΪԭ��ص�����������ԭ��غ����ĸ�ʴ�ٶȴ��ӿ죬�������������࣬ʱ�䳤�ˣ��п����������֣�
(2)ͭ��Ϊԭ��صĸ������������Һ�к��������ӵ�����Һ�����Ը����ĵ缫��ӦʽΪ��Cu-2e-=Cu2+�������ĵ缫��ӦʽΪ��Fe3++e-=Fe2+���ʴ�Ϊ��Cu-2e-=Cu2+��Fe3++e-=Fe2+��
(3)ͭ���Ȼ�����Ӧ�У�������ʧ���ӵ��ǽ���ͭ������Cuһ���������������Ϊ�Ȼ���������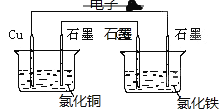 ��������֤Cu2+��Fe3+�����Ե�ǿ�����ʴ�Ϊ��
��������֤Cu2+��Fe3+�����Ե�ǿ�����ʴ�Ϊ�� ��
��

 ��ҵ����ϵ�д�
��ҵ����ϵ�д�����Ŀ����1��ʵ���ã�5gҺ̬�״�(CH3OH)�������г��ȼ�����ɶ�����̼�����Һ̬ˮʱ�ͷų�113��5kJ����������д���״�ȼ�յ��Ȼ�ѧ����ʽ____________________________________��
��2����֪��ӦN2+3H2![]() 2NH3 ��H=akJ/mol���Ը����±������м������ݹ���a����ֵΪ______��
2NH3 ��H=akJ/mol���Ը����±������м������ݹ���a����ֵΪ______��
��ѧ�� | H-H | N-H | N��N |
����kJ/mol | 436 | 391 | 945 |
��3�����ݸ�˹���ɿ��Զ�ijЩ����ͨ��ʵ��ֱ�Ӳⶨ�Ļ�ѧ��Ӧ���ʱ�������㡣
��֪��C(s��ʯī)+O2(g)=CO2(g) ��Hl=-393. 5kJ/mol
2H2(g)+O2(g)=2H2O(l) ��H2=-571.6kJ/mol
2C2H2(g) +5O2(g) =4CO2(g) +2H2O(1) ��H3=-2599kJ/mol
���Ƹ�˹���ɣ�����298Kʱ��C(s,ʯī)��H2(g)����1mol C2H2(g)��Ӧ�Ȼ�ѧ����ʽ:__________��
