题目内容
 有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH+4、K+、Mg2+、Cu2+、Al3+、NO-3、CO2-3、SO2-4,现取三份100mL溶液进行如下实验
有一未知的无色溶液,只可能含有以下离子中的若干种:H+、NH+4、K+、Mg2+、Cu2+、Al3+、NO-3、CO2-3、SO2-4,现取三份100mL溶液进行如下实验①第一份加足量AgNO3溶液后,有白色沉淀产生.
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g.
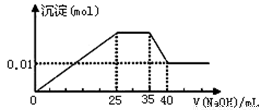
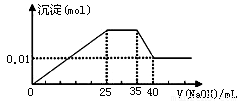
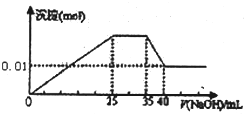
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.
根据上述实验,以下推测不正确的是( )
| A、原溶液一定不存在H+、Cu2+、CO2-3 | B、不能确定原溶液是否含有K+、NO-3 | C、原溶液确定含Mg2+、Al3+、NH+4,且n(Mg2+):n(Al3+):n(NH+4)=1:1:2 | D、实验所加的NaOH的浓度为2 mol?L-1 |
分析:根据无色溶液可知,有颜色的离子不能存在,一定不含Cu2+;
①第一份加足量AgNO3溶液后,有白色沉淀产生,所以推断一定有CO32-、SO42-两种离子中的一种;
③第三份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,含有硫酸根离子;
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,则溶液中n(SO42-)=
=0.03mol.
①第一份加足量AgNO3溶液后,有白色沉淀产生,所以推断一定有CO32-、SO42-两种离子中的一种;
③第三份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,含有硫酸根离子;
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,则溶液中n(SO42-)=
| 6.99g |
| 233g/mol |
解答:解:根据无色溶液可知,有颜色的离子不能存在,一定不含Cu2+;
①第一份加足量AgNO3溶液后,有白色沉淀产生,所以推断一定有CO32-、SO42-两种离子中的一种;
③第三份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,含有硫酸根离子;
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,则溶液中n(SO42-)=
=0.03mol;
A.通过以上分析知,溶液中一定不存在H+、Cu2+、CO32-,故A正确;
B.当加入40mLNaOH溶液时,剩余的沉淀是Mg(OH)2,n(Mg(OH)2)=0.01mol,根据原子守恒知,n(Mg2+)=0.01mol,c(Mg2+)=
=0.2mol/L生成0.01molMg(OH)2需要n(NaOH)是0.02mol,Al(OH)3和NaOH反应生成NaAlO2需要NaOH溶液的体积是5mL,则铝离子和NaOH溶液反应生成Al(OH)3沉淀时需要NaOH溶液的体积是15mL,则生成氢氧化镁需要NaOH溶液的体积是10mL,所以c(NaOH)=
=2mol/L,氢氧化铝和NaOH溶液反应生成NaAlO2时,结合原子守恒知,c(Al3+)=
=0.1mol/L,c(NH4+)=
=0.2mol/L,溶液中c(SO42-)=
=0.3mol/L,
根据溶液中电荷守恒知,2c(Al3+)+c(NH4+)+2(Mg2+)>2c(SO42-),所以溶液中还存在硝酸根离子,故B错误;
C.根据图象知,35-40mL时Al(OH)3和NaOH反应生成NaAlO2,则0-25mL时NaOH和Mg2+、Al3+反应生成沉淀,生成NaAlO2时需要NaOH5mL,则生成Al(OH)3需要NaOH 15mL,则有10mLNaOH溶液和镁离子反应,25-35mL时氢氧化钠溶液和NH+4反应生成氨水,根据使用NaOH溶液体积知,n(Mg2+):n(Al3+):n(NH+4)=1:1:2,故C正确;
D.通过B知,c(NaOH)=
=2mol/L,故D正确;
故选B.
①第一份加足量AgNO3溶液后,有白色沉淀产生,所以推断一定有CO32-、SO42-两种离子中的一种;
③第三份逐滴滴加NaOH 溶液,由图可知,开始加入氢氧化钠溶液就有沉淀生成,说明不含有H+;沉淀最大时,继续滴加氢氧化钠溶液,沉淀部分溶解,推断一定含有Al3+;图象中有一段平台,说明加入OH-时无沉淀生成,有NH4+,NH4++OH-=NH3?H2O,说明含有铵根离子,最后溶液中有沉淀,说明溶液中含Mg2+,镁离子和碳酸根离子不共存,所以溶液中一定不含碳酸根离子,含有硫酸根离子;
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99g,则溶液中n(SO42-)=
| 6.99g |
| 233g/mol |
A.通过以上分析知,溶液中一定不存在H+、Cu2+、CO32-,故A正确;
B.当加入40mLNaOH溶液时,剩余的沉淀是Mg(OH)2,n(Mg(OH)2)=0.01mol,根据原子守恒知,n(Mg2+)=0.01mol,c(Mg2+)=
| 0.02mol |
| 0.1L |
| 0.02mol |
| 0.01L |
| 2mol/L×0.005L |
| 0.1L |
| 2mol/L×0.01L |
| 0.1L |
| 0.03mol |
| 0.1L |
根据溶液中电荷守恒知,2c(Al3+)+c(NH4+)+2(Mg2+)>2c(SO42-),所以溶液中还存在硝酸根离子,故B错误;
C.根据图象知,35-40mL时Al(OH)3和NaOH反应生成NaAlO2,则0-25mL时NaOH和Mg2+、Al3+反应生成沉淀,生成NaAlO2时需要NaOH5mL,则生成Al(OH)3需要NaOH 15mL,则有10mLNaOH溶液和镁离子反应,25-35mL时氢氧化钠溶液和NH+4反应生成氨水,根据使用NaOH溶液体积知,n(Mg2+):n(Al3+):n(NH+4)=1:1:2,故C正确;
D.通过B知,c(NaOH)=
| 0.02mol |
| 0.01L |
故选B.
点评:本题考查了离子共存、离子反应的计算等知识点,定性分析离子共存、定量分析离子的物质的量是解本题的关键,题目难度中等.

练习册系列答案
相关题目
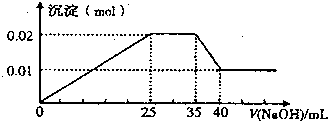
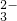 、SO
、SO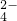 ,现取三份100mL溶液进行如下实验:
,现取三份100mL溶液进行如下实验:
 +,其物质的量之比n(Mg2+):n(Al3+):n(NH
+,其物质的量之比n(Mg2+):n(Al3+):n(NH -的物质的量为n (NO3-),则n(NO3-)的取值范围为:______.
-的物质的量为n (NO3-),则n(NO3-)的取值范围为:______.