题目内容
(17分)实验室需要0.1 mol/L NaOH溶液450 mL,需要0.5 mol/L硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:
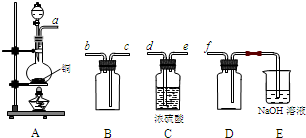
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称).
(2)根据计算用托盘天平称取NaOH的质量为 g.
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为
mL(计算结果保留一位小数).如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL的量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(4)取用任意体积的所配0.5 mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是(填字母)
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液中SO42-的数目 D.溶液的密度
(5)将所配制的稀H2SO4进行测定,发现浓度大于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.用量筒量取浓硫酸时,仰视量筒的刻度
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
(1)肯定不需要的是 A C (填序号),
还需用到的玻璃仪器是 烧杯 玻璃棒 (填仪器名称).
(2)称取NaOH的质量为 2.0 g.
(3)所需浓硫酸的体积为 13.6 mL(计算结果保留一位小数).
应选用 15 mL的量筒最好.
稀释时操作方法是 将烧杯中倒入适量的水,将量筒中的浓硫酸沿烧杯壁慢慢注入烧杯,边加
边用玻璃棒不断搅拌,使之冷却
(4) B D
(5) C E F
解析:

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案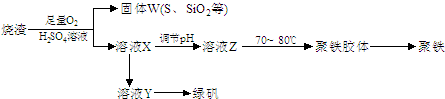
 (2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
(2013?江苏三模)碳酸钠-过氧化氢加合物(aNa2CO3?bH2O2)具有漂白、杀菌作用.实验室用“醇析法”制备该物质的实验步骤如下:
