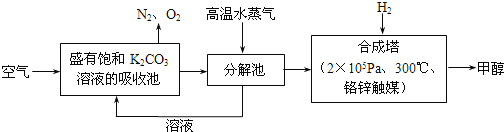
题目内容
【题目】下列物质,是强电解质的是( )
A.硫酸钡 B.石墨 C.浓盐酸 D.HF
【答案】A
【解析】
试题分析:A、硫酸钡为盐,属于强电解质,正确;B、石墨为单质,既不是电解质也不是非电解质,错误;C、浓盐酸为混合物,既不是电解质也不是非电解质,错误;D、HF为弱酸,属于弱电解质,错误。

【题目】(1)常温常压下,依据事实,写出下列反应的热化学方程式。
①在25℃、101kPa下,2g甲醇燃烧生成CO2和液态水时放热45kJ。则表示甲醇燃烧热的热化学方程式为______________________。
②若适量的N2和O2完全反应,每生成23g NO2需要吸收17kJ热量__________________。
(2)断裂1mol(理想)气体分子化学键所吸收的能量或形成1mol(理想)气体分子化学键所放出的能量称为键能(单位为KJ.mol-1)下表是一些键能数据(KJ·mol-1)
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C—H | 414 | C—F | 489 | H—F | 565 | F—F | 158 |
H-H | 436 | H-N | 391 |
①根据键能数据计算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g) △H
②根据键能和反应热化学方程式1/2N2(g)+3/2H2(g) =NH3(g ) △H = —46 kJ·mol-1 计算N≡N的键能。
(3)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256kJ的热量(25℃、101 kPa下测得的热量)。
①该反应的热化学方程式为 。
②又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。