题目内容
【题目】利用铜—氯热化学循环可制取氢气,主要流程如下:

回答下列问题:
(1)图中属于氧化还原反应的是__________(填序号)。
(2)已知25℃时,Ksp(CuOH)=2.0×10-15,Ksp(CuC1)=1.0×10-6,则反应CuC1(s)+H2O(1)![]() CuOH(s)+Cl-(aq)+H+(aq)的平衡常数K=___________(填数值)。
CuOH(s)+Cl-(aq)+H+(aq)的平衡常数K=___________(填数值)。
(3)已知:
Cl2(g)+H2O(g)==2HCl(g)+1/2O2(g) △H1
2CuCl(s)+2HCl(g)==2CuCl2(s)+H2(g) △H2
Cl2(g)+2CuCl(l)==2CuCl2(s) △H3
CuC1(l)==CuC1(s) △H4
则反应H2O(g)==H2(g)+1/2O2(g) △H=_______(用△H1、△H2、△H3、△H4表示)。
(4)反应Ⅱ若在水溶液中进行可用惰性电极电解实现,其装置如下图所示。阳极的电极反应式为____________________;电解过程中阳极周围溶液的pH__________(填“升高”或“降低”)。

(5)反应I是可逆反应,工业上也常用该反应生成的HC1制取氯气,反应为4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g),在不同起始投料比m下,HC1平衡转化率随温度的变化关系如下图所示:
2Cl2(g)+2H2O(g),在不同起始投料比m下,HC1平衡转化率随温度的变化关系如下图所示:

①该反应的正反应为___________热反应(填“放”或“吸”)。
②图中m2________m1(填“>”或“<”)。
③p kPa下,A点对应温度下反应的平衡常数Kp=________kPa-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算式即可)。
【答案】 I、II、III 5×10-6 △H1+△H2-△H3+2△H4 CuCl-e-=Cu2++Cl- 升高 放 > ![]()
【解析】(1)Ⅳ是物理变化,其余三个反应中均涉及元素化合价的变化,故反应I、II、III均是氧化还原反应;(2)K=c(H+)c(Cl-)=![]() =
=![]() =5×10-6;(3)由I+II-III+2Ⅳ可得反应H2O(g)==H2(g)+1/2O2(g),根据盖斯定律可得:△H=△H 1+△H2-△H3+2△H4;(4)阳极上CuCl被氧化为CuCl2,反应的电极反应式为:CuCl-e-=Cu2++Cl-;阴极上H+得到电子生成H2,由于H+透过质子交换膜,故阳极周围溶液的PH升高;(5)①根据图中信息可知,温度升高,HC1平衡转化率降低,则平衡向逆反应方向移动,逆反应方向为吸热反应,则该反应的正反应为放热反应;②当氧气一定时,HC1投入比越大,HC1平衡转化率越低,故图中m2>m1;③ 4HCl(g)+O2(g)
=5×10-6;(3)由I+II-III+2Ⅳ可得反应H2O(g)==H2(g)+1/2O2(g),根据盖斯定律可得:△H=△H 1+△H2-△H3+2△H4;(4)阳极上CuCl被氧化为CuCl2,反应的电极反应式为:CuCl-e-=Cu2++Cl-;阴极上H+得到电子生成H2,由于H+透过质子交换膜,故阳极周围溶液的PH升高;(5)①根据图中信息可知,温度升高,HC1平衡转化率降低,则平衡向逆反应方向移动,逆反应方向为吸热反应,则该反应的正反应为放热反应;②当氧气一定时,HC1投入比越大,HC1平衡转化率越低,故图中m2>m1;③ 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)
2Cl2(g)+2H2O(g)
起始时的物质的量/mol 4a a 0 0
转化的物质的量/mol 3.6a 0.9a 1.8a 1.8a
平衡时的物质的量/mol 0.4a 0.1a 1.8a 1.8a
总物质的量为0.4a+0.1a+1.8a+1.8a=4.1a,HCl、O2、Cl2及H2O(g)的物质的量分数分别为![]() 、
、![]() 、
、![]() 、
、![]() 。K=
。K=![]() =
=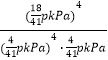 =
=![]() kPa-1。
kPa-1。

【题目】如表各组物质之间通过一步反应不可以实现如图所示转化关系的是( )
选项 | X | Y | Z | 箭头上所标数字的反应条件 |
A | Na2O2 | NaOH | NaCl | ①常温遇水 |
B | Al2O3 | NaAl(OH)4 | Al(OH)3 | ②通入CO2 |
C | NO | NO2 | HNO3 | ④加入铜粉 |
D | C | CO | CO2 | ③点燃镁条 |

A.A
B.B
C.C
D.D





