题目内容
某CuO粉末与适量的硫酸在微热下充分反应,冷却后恰好全部形成CuSO4?5H2O(设反应过程中无水份损失).则此硫酸溶液的物质的量浓度为( )A.8.5mol?L-1
B.10.0mol?L-1
C.17.0mol?L-1
D.18.4mol?L-1
【答案】分析:CuO粉末与适量的硫酸微热下充分反应,冷却后恰好全部形成CuSO4?5H2O,可以改写呈成CuO?H2SO4?4H2O,故原硫酸溶液中m(H2SO4):m(H2O)=98:4×18=98:72,据此计算硫酸的质量分数,再根据c= 计算该硫酸的物质的量浓度.
计算该硫酸的物质的量浓度.
解答:解:CuO粉末与适量的硫酸微热下充分反应,冷却后恰好全部形成CuSO4?5H2O,可以改写呈成CuO?H2SO4?4H2O,故原硫酸溶液中m(H2SO4):m(H2O)=98:4×18=98:72,故该硫酸的质量分数为 =
=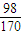 ,该硫酸的密度ρ=1.7g?cm-3,故该硫酸的物质的量浓度c=
,该硫酸的密度ρ=1.7g?cm-3,故该硫酸的物质的量浓度c= mol/L=10mol/L,
mol/L=10mol/L,
故选B.
点评:本题考查物质的量浓度的有关计算,难度较大,注意利用化学式改写的方法计算原硫酸溶液中硫酸的质量分数.
 计算该硫酸的物质的量浓度.
计算该硫酸的物质的量浓度.解答:解:CuO粉末与适量的硫酸微热下充分反应,冷却后恰好全部形成CuSO4?5H2O,可以改写呈成CuO?H2SO4?4H2O,故原硫酸溶液中m(H2SO4):m(H2O)=98:4×18=98:72,故该硫酸的质量分数为
 =
=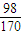 ,该硫酸的密度ρ=1.7g?cm-3,故该硫酸的物质的量浓度c=
,该硫酸的密度ρ=1.7g?cm-3,故该硫酸的物质的量浓度c= mol/L=10mol/L,
mol/L=10mol/L,故选B.
点评:本题考查物质的量浓度的有关计算,难度较大,注意利用化学式改写的方法计算原硫酸溶液中硫酸的质量分数.

练习册系列答案
相关题目
某CuO粉末与适量的硫酸(ρ=1.7g·cm-3)在微热下充分反应,冷却后恰好全部形成CuSO4·5H2O(设反应过程中无水份损失)。则此硫酸溶液的物质的量浓度为
| A.8.5mol·L-1 | B.10.0mol·L-1 | C.17.0mol·L-1 | D.18.4mol·L-1 |