题目内容
【题目】能通过化学反应使溴水褪色,又能使酸性高锰酸钾溶液褪色的是( )
A.苯B.乙烯C.乙烷D.乙酸
【答案】B
【解析】
烯烃能使溴水和高锰酸钾褪色,分别发生加成反应和氧化还原反应。
乙烯既能通过与溴发生加成反应而使溴水褪色,又能被酸性高锰酸钾溶液氧化,而使酸性高锰酸钾溶液褪色。苯、乙烷、乙酸既不能与溴水反应,也不能使酸性高锰酸钾溶液褪色。
答案选B。

【题目】下图是实验室制取气体装置,其中发生装置相同(省去了铁架台和锥形瓶中的药品),干燥和收集装置有二套,分别用图一和图二。下列选项中不正确的是( )
A | 锌和稀盐酸 | 选用图1 |
B | 碳化钙和饱和食盐水 | 选用图1 |
C | 铜和浓硫酸 | 选用图2 |
D | 过氧化钠和水 | 选用图2 |

A. A B. B C. C D. D
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)K2FeO4作为高效、多功能水处理剂的原因是______________________________。
(2)制备K2FeO4(夹持装置略)
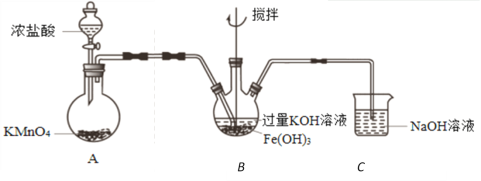
①A为氯气发生装置。A中反应方程式是_____________________________。
②该装置有明显不合理设计,如何改进?____________________________。
③改进后,B中得到紫色固体和溶液。B中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有____________________________。
(3)探究K2FeO4的性质(改进后的实验)
①取B中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤B中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
a.由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由_________________________产生(用方程式表示)。
b.方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________。
②根据K2FeO4的制备实验和方案Ⅱ实验表明Cl2和![]() 的氧化性强弱关系相反,原因是_____________。
的氧化性强弱关系相反,原因是_____________。

