题目内容
过碳酸钠(Na2CO4)和稀硫酸反应的化学方程式为:2Na2CO4 +2H2SO4![]() 2Na2SO4+O2↑+2H2O+2CO2↑
2Na2SO4+O2↑+2H2O+2CO2↑
某过碳酸钠样品中含有少量Na2O2,甲、乙两位同学各称质量为mg的该样品,选用下图所示的仪器组合成测定样品的纯度的装置。仪器的连接顺序,甲是①⑦③⑥④;乙是①②。
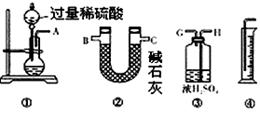
(1)甲同学想通过实验测得的数据是 。他连接装置的顺序存在错误,调整的方法是 。
(2)乙同学想通过实验测得的数据是 。按他测得的数据计算出来的实验结果 (填“偏高”、“偏低”或“无影响”),理由是 。
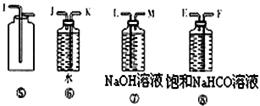
(3)为了测得准确的实验数据,请你将乙同学的实验装置进行改进,写出各接口的连接顺序: 。
(4)按你改进的实验装置进行实验,若测得实验前后装置②的质量分别是W1g和W2g,则样品中过碳酸钠的质量分数为 。
(1)CO2的质量和O2的体积 ⑦与③交换位置![]()
![]()
![]()
![]()
![]()
![]()
![]()
(2)CO2的质量 偏高 碱石灰吸收了水蒸气
(3)A接H,G接B (4)![]()
解析:
实验的目的是测定Na2CO4样品的纯度,可能含有少量Na2O2。Na2CO4和稀硫酸反应、Na2O2和稀硫酸反应均有O2放出,实验可通过测定CO2的质量来求算Na2CO4的纯度,在用碱石灰吸收CO2之前,需先除去CO2中的水蒸气,否则实验测得的数据会偏高,故甲同学的实验中⑦与③应交换位置,乙同学应增加③浓硫酸。

练习册系列答案
相关题目