题目内容
在HNO2溶液中存在如下平衡:HNO2?H++NO2-,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是( )
分析:根据化学平衡移动原理来确定电离平衡的移动方向.
解答:解:A、根据平衡HNO2?H++NO2-,加入NaOH溶液会和氢离子反应,消耗氢离子,所以平衡正向移动,故A正确;
B、根据平衡HNO2?H++NO2-,加入硫酸溶液会增大氢离子浓度,所以平衡逆向移动,故B错误;
C、根据平衡HNO2?H++NO2-,加入亚硝酸钠,浓度增大,NO2-平衡逆向移动,故C错误;
D、根据平衡HNO2?H++NO2-,加入硫酸氢钠溶液会增大氢离子浓度,所以平衡逆向移动,故D错误.
故选A.
B、根据平衡HNO2?H++NO2-,加入硫酸溶液会增大氢离子浓度,所以平衡逆向移动,故B错误;
C、根据平衡HNO2?H++NO2-,加入亚硝酸钠,浓度增大,NO2-平衡逆向移动,故C错误;
D、根据平衡HNO2?H++NO2-,加入硫酸氢钠溶液会增大氢离子浓度,所以平衡逆向移动,故D错误.
故选A.
点评:本题考查学生弱电解质的电离平衡的移动知识,可以根据化学平衡移动原理来回答,难度不大.

练习册系列答案
相关题目
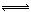 H+
+ NO2- ,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是 ( )
H+
+ NO2- ,向该溶液中加入少量的下列物质后,能使电离平衡向右移动的是 ( )