题目内容
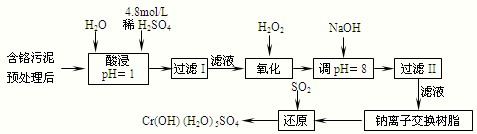
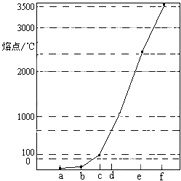 (2011?闵行区二模)如图是Na、Al、Si、H、C、N等元素某种常见单质的熔点高低的顺序,其中c、d均是热和电的良导体.
(2011?闵行区二模)如图是Na、Al、Si、H、C、N等元素某种常见单质的熔点高低的顺序,其中c、d均是热和电的良导体.(1)请写出上图中d单质对应元素离子的电子排布式为
1s22s22p6
1s22s22p6
.c、d单质对应元素的原子半径大小关系为Na>Al
Na>Al
(用元素符号表示).(2)单质a、f对应的元素以原子个数比1:1形成的分子,相同条件下该物质的密度为H2 的13倍,则其结构式为
H-C≡C-H
H-C≡C-H
.(3)a与b的元素形成的10电子中性分子X的空间构型为
三角锥形
三角锥形
;将X溶于水后的溶液逐滴加入到AgNO3溶液中至过量,观察到的实验现象是先产生沉淀,沉淀达到最大后有逐渐溶解,直至完全消失
先产生沉淀,沉淀达到最大后有逐渐溶解,直至完全消失
.(4)e、f 单质对应元素的最简单气态氢化物的热稳定性(用相应的化学式)
CH4
CH4
>SiH4
SiH4
.(5)用一个化学方程式说明b、f单质对应元素的非金属性强弱
HNO3+NaHCO3═NaNO3+CO2↑+H2O
HNO3+NaHCO3═NaNO3+CO2↑+H2O
.分析:由图是Na、Al、Si、H、C、N等元素某种常见单质的熔点高低的顺序,则f为金刚石,a为Si,c、d均是热和电的良导体,d为Al,c为Na,b为氮气,a为氢气,
(1)d为Al,其离子核外有10个电子,Na、Al为同周期元素,原子序数大的原子半径小;
(2)a、f对应的元素以原子个数比1:1形成的分子,相同条件下该物质的密度为H2 的13倍,M=13×2=26g/mol,有机物为乙炔;
(3)a与b的元素形成的10电子中性分子X为NH3,X溶于水后的溶液逐滴加入到AgNO3溶液中至过量可得到银氨溶液;
(4)非金属性越强,气态氢化物越稳定;
(5)利用强酸制取弱酸的反应可知b、f单质对应元素的非金属性强弱.
(1)d为Al,其离子核外有10个电子,Na、Al为同周期元素,原子序数大的原子半径小;
(2)a、f对应的元素以原子个数比1:1形成的分子,相同条件下该物质的密度为H2 的13倍,M=13×2=26g/mol,有机物为乙炔;
(3)a与b的元素形成的10电子中性分子X为NH3,X溶于水后的溶液逐滴加入到AgNO3溶液中至过量可得到银氨溶液;
(4)非金属性越强,气态氢化物越稳定;
(5)利用强酸制取弱酸的反应可知b、f单质对应元素的非金属性强弱.
解答:解:由图是Na、Al、Si、H、C、N等元素某种常见单质的熔点高低的顺序,则f为金刚石,a为Si,c、d均是热和电的良导体,d为Al,c为Na,b为氮气,a为氢气,
(1)d为Al,其离子核外有10个电子,其离子的电子排布为1s22s22p6,Na、Al为同周期元素,原子序数大的原子半径小,则原子半径为Na>Al,故答案为:1s22s22p6;Na>Al;
(2)a、f对应的元素以原子个数比1:1形成的分子,相同条件下该物质的密度为H2 的13倍,M=13×2=26g/mol,有机物为乙炔,其结构简式为H-C≡C-H,故答案为:H-C≡C-H;
(3)a与b的元素形成的10电子中性分子X为NH3,空间构型为三角锥形,X溶于水后的溶液逐滴加入到AgNO3溶液中至过量可得到银氨溶液,观察到先产生沉淀,沉淀达到最大后有逐渐溶解,直至完全消失,故答案为:三角锥形;先产生沉淀,沉淀达到最大后有逐渐溶解,直至完全消失;
(4)非金属性越强,气态氢化物越稳定,非金属性C>Si,则最简单气态氢化物的热稳定性为CH4>SiH4,故答案为:CH4;SiH4;
(5)由强酸制取弱酸的反应可知b、f单质对应元素的非金属性强弱,如HNO3+NaHCO3═NaNO3+CO2↑+H2O,故答案为:HNO3+NaHCO3═NaNO3+CO2↑+H2O.
(1)d为Al,其离子核外有10个电子,其离子的电子排布为1s22s22p6,Na、Al为同周期元素,原子序数大的原子半径小,则原子半径为Na>Al,故答案为:1s22s22p6;Na>Al;
(2)a、f对应的元素以原子个数比1:1形成的分子,相同条件下该物质的密度为H2 的13倍,M=13×2=26g/mol,有机物为乙炔,其结构简式为H-C≡C-H,故答案为:H-C≡C-H;
(3)a与b的元素形成的10电子中性分子X为NH3,空间构型为三角锥形,X溶于水后的溶液逐滴加入到AgNO3溶液中至过量可得到银氨溶液,观察到先产生沉淀,沉淀达到最大后有逐渐溶解,直至完全消失,故答案为:三角锥形;先产生沉淀,沉淀达到最大后有逐渐溶解,直至完全消失;
(4)非金属性越强,气态氢化物越稳定,非金属性C>Si,则最简单气态氢化物的热稳定性为CH4>SiH4,故答案为:CH4;SiH4;
(5)由强酸制取弱酸的反应可知b、f单质对应元素的非金属性强弱,如HNO3+NaHCO3═NaNO3+CO2↑+H2O,故答案为:HNO3+NaHCO3═NaNO3+CO2↑+H2O.
点评:本题考查元素的性质及晶体类型与熔点,明确熔点原子晶体大于金属晶体大于分子晶体来推断各元素是解答本题的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目