题目内容
将一小块金属钠投入到100mL含MgCl2和AlCl3的混合溶液中,发现沉淀先多后少。反应完毕后收集到13.44L气体(标准状况下),同时得到21.4g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6g。求原溶液Mg2+、Al3+的物质的量浓度。
有关反应:2Na+2H2O=2NaOH+H2↑ Mg2++2OH―=Mg(OH)2↓ Al3++3OH―=Al(OH) 3↓ Al(OH)3+OH―=AlO2―+2H2O 最后所得沉淀应为Mg(OH)2
n[Mg(OH)2]=![]()
![]() (3分)
(3分)
n(NaOH)=n(H2)?2=![]()
沉淀Mg2+耗NaOH:0.1mol×2=0.2mol
21.4g沉淀中含Al(OH)3:![]()
沉淀0.2mol Al3+耗NaOH:0.2mol×3=0.6mol
沉淀Mg2+和Al3+共耗NaOH:0.2mol+0.6mol=0.8mol,剩余NaOH,则发生如下反应:
Al3+ + 4OH― = AlO2― + 2H2O
1 4
n(Al3+) 1.2mol-0.8mol n(Al3+)=0.1mol
共有n(Al3+)=0.2mol+0.1mol=0.3mol c(Al3+)=![]()

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 Ca2+=CaCO3↓+H2O
Ca2+=CaCO3↓+H2O +H2O
+H2O OH- +CO
OH- +CO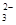
 Ca2+=CaCO3↓+H2O
Ca2+=CaCO3↓+H2O +H2O
+H2O OH-+CO
OH-+CO
 12H++Cl-+ClO-
12H++Cl-+ClO-