题目内容
【题目】亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
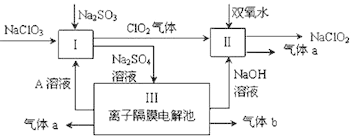
⑴ Ⅰ中发生反应的化学方程式是________________________,氧化剂与还原剂的物质的量之比是____________________;
⑵ Ⅱ中反应的离子方程式是_________________________;
⑶ 装置Ⅲ中阳极的反应是_________________________;
⑷ ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O
① 该反应中盐酸的作用是__________;② 写出实验室制氯气的离子方程式______________;说明上述两反应中盐酸作用不同的原因___________________________。
【答案】2NaClO3+ Na2SO3+ H2SO4=2Na2SO4 + 2ClO2↑+ H2O2 : 12ClO2+ H2O2+ 2OH-= 2ClO2- + O2↑+ 2H2O4OH-- 4e-==2H2O + O2↑起酸的作用MnO2+4H+ + 2Cl-=Mn2++Cl2↑+2H2O盐酸浓度越大,还原性越强
【解析】(1)由流程图可知反应Ⅰ,反应物为NaClO3、Na2SO3、加入A溶液,产生C1O2、Na2SO4溶液,反应的化学方程式为2NaClO3+ Na2SO3+ H2SO4=2Na2SO4 + 2C1O2↑+ H2O,所以Na2SO3具有还原性,是还原剂,NaClO3是氧化剂,氧化剂与还原剂的物质的量之比是2:1,故答案为:2NaClO3+ Na2SO3+ H2SO4=2Na2SO4 + 2C1O2↑+ H2O;2:1;
(2)Ⅱ中反应根据流程信息可知,生成NaClO2,所以一定有ClO2→NaClO2,化合价降低,被还原;则H2O2必定被氧化,有氧气产生,反应中ClO2是氧化剂,发生还原反应,H2O2是还原剂,发生氧化反应,根据电子转移守恒可知4n(ClO2)=n(HCl),所以反应的离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)Ⅲ为电解硫酸钠本质是电解水,阴极2H++2e-=H2↑,阳极4OH--4e-=O2↑+2H2O, 故答案为:4OH--4e-=O2↑+2H2O;
⑷ ①5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反应中,4NaClO2→4ClO2,+3价的氯元素化合价升高到+4价,所以NaClO2是还原剂;1NaClO2→1NaCl,+3价的氯元素的化合价降低到-1价,所以部分NaClO2作氧化剂,反应中盐酸既不是氧化剂也不是还原剂,只起了酸的作用,故答案为:起酸的作用;
②实验室用二氧化锰和浓盐酸制备氯气,反应的离子方程式为MnO2+4H+ + 2Cl-=Mn2++Cl2↑+2H2O,反应中盐酸是酸和还原剂,上述两反应中盐酸作用不同的原因是盐酸浓度越大,还原性越强,故答案为:MnO2+4H+ + 2Cl-=Mn2++Cl2↑+2H2O;盐酸浓度越大,还原性越强。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案