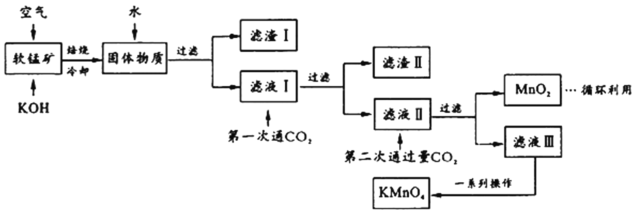
��Ŀ����
����Ŀ�����ײ���һֱ�������о�����Ҫ���⣬��������Fe�۱�������г�ǿ�Ĵ��ԡ���Ч���Ե����������ʡ�
��.ʵ���Ҳ������ԭ���Ʊ�����Fe����������ͼ��ʾ����
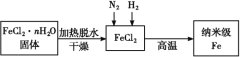
��1������Fe��ϡ���ᷴӦ�����ӷ���ʽΪ_____��
��2����ν�FeCl2��nH2O���������ˮ�Ƶ���ˮFeCl2��____(�ü�Ҫ��������)��
��3����������Fe�Ļ�ѧ����ʽΪ____��
��.�������ϣ��ڲ�ͬ�¶��£�����Fe����ˮ������Ӧ�Ĺ�����ﲻͬ���¶ȵ���570��ʱ����FeO������570��ʱ����Fe3O4����ͬѧ��ͼ����ʾװ�ý�������Fe����ˮ������Ӧ��ʵ�飬��ͬѧ��ͼ����ʾ��װ�ý�������Fe����ˮ�����ķ�Ӧ����֤���

��4����װ��������Fe����ˮ������Ӧ�Ļ�ѧ����ʽ��_____��
��5����װ��������a������Ϊ_____��
��6����ͬѧ��ȡ5.60gFe�ۣ�����װ�÷�Ӧһ��ʱ���ֹͣ���ȡ����Թ��ڵĹ��������ڸ���������ȴ�Ƶ�����Ϊ6.88g����ͬѧʵ���Ĺ������������������������Ϊ_____(���������λ��Ч����)��
���𰸡�Fe+2H+=Fe2++H2�� �ڸ����HCl�����м��� FeCl2+H2![]() Fe+2HCl Fe+H2O(g)
Fe+2HCl Fe+H2O(g)![]() FeO+H2 ������ 67.4%
FeO+H2 ������ 67.4%
��������
��.��1���������ᷴӦ�����Ȼ�������������
��2��FeCl2nH2O���������ˮʱ������������ˮ�������������������Ȼ��⣬Ϊ��ֹˮ����Խ�����HCl��Χ�м��ȣ�
��3����������ͼ��֪���ڸ�����������������ԭ�Ȼ������ɵ�����Fe��
��.��4��Fe����ˮ�����ڼ��������·�Ӧ����FeO��������
��5�����������Ľṹ������ȷ������a�����ƣ�
��6������ˮ������Ӧ������������������������Ϲ������������ж�������ɷ֡�
��.��1���������ᷴӦ�����Ȼ������������������ӷ�Ӧ����ʽΪFe+2H+=Fe2++H2����
��2��FeCl2nH2O���������ˮͨʱ������������ˮ�������������������Ȼ��⣬Ϊ��ֹFeCl2ˮ�⣬FeCl2nH2O���������ˮͨ��Ҫͨ������HCl���壬HCl������FeCl2ˮ�⣬��ͨ���HCl����ɴ���ˮ����������FeCl2nH2O������ˮ���ʴ�Ϊ���ڸ����HCl�����м��ȣ�
��3����������ͼ��֪���ڸ�����������������ԭ�Ȼ������ɵ�����Fe����Ӧ����ʽΪ![]() ��
��
��. ��4��Fe����ˮ�����ڼ��������·�Ӧ����FeO������������ʽΪ![]() ��
��
��5����װ��������a������Ϊ�����ʴ�Ϊ��������
��6������װ�÷�Ӧ����Ӧ�¶ȸ���570������Fe����ˮ������Ӧ�Ĺ������ΪFe3O4����Ӧ�����ù��������Ϊ6.88g��������ԭ�ӵ�����Ϊm(O)=6.88g-5.60g=1.28g����n(O)=![]() =0.08mol���ɹ�ϵʽ1Fe3O4��4O���ɵ�n��Fe3O4��=0.02mol�����Թ������������������������=
=0.08mol���ɹ�ϵʽ1Fe3O4��4O���ɵ�n��Fe3O4��=0.02mol�����Թ������������������������=![]() ��100%��67.4%���ʴ�Ϊ��67.4%��
��100%��67.4%���ʴ�Ϊ��67.4%��

����Ŀ��CO2��CH4���Ƶúϳ�����CH4(g)��CO2(g)2CO(g)��2H2(g) ��H=+247 kJ��mol��1����ʼ�¶Ⱦ�ΪT Kʱ����3�������а���ͬ��ʽͶ�뷴Ӧ�����������Ӧ�������Ϣ���±���
���� | ��ʼ���ʵ���/mol | CO2ƽ��ת����(��) | |||||
��� | �ݻ�/L | ���� | CH4(g) | CO2(g) | CO(g) | H2(g) | |
�� | 2 | ���º��� | 2 | 1 | 0 | 0 | 50% |
�� | 1 | 0.5 | 1 | 0 | 0 | ||
�� | 1 | ���Ⱥ��� | 1 | 0.5 | 0 | 0 | �� |
����˵����ȷ����
A.T Kʱ����ӦCH4(g)��CO2(g)2CO(g)��2H2(g)��ƽ�ⳣ��Ϊ1/3
B.�������з�Ӧ�ﵽƽ��ʱ����(CO2����)=50%
C.�������з�Ӧ�ﵽƽ��ʱ��Ӧ����123.5��247 kJ��mol��1��Χ��
D.�������з�Ӧ�ﵽƽ��ʱ����Ͷ��0.5 mol CH4��0.25 mol CO����Ӧ�ﵽ��ƽ��ǰ��v(��)<v(��)