题目内容
【题目】在研究弱电解质的电离、盐类的水解和溶液中离子浓度大小比较中,某师生共同做了这样一个实验:常温下,向20.0mL,0.1mol/L CH3COOH溶液中逐滴加入0.01mol/L NaOH溶液,并在滴加过程中不断用pH计测量混合溶液的pH,绘出pH—V(NaOH)图像,如图所示。请分析:
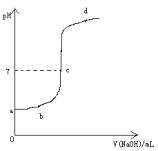
(1)在滴加NaOH溶液至过量过程中的溶液中溶质的变化情况,a、b、c、d各点的溶质各是什么?
(2)CH3COOH与NaOH恰好完全反应的点在图像中的位置在 区域内。(填:pH>7或pH<7或 pH=7),由此可验证CH3COOH为 (填:弱酸或强酸)此时共滴加V(NaOH)= mL。
(3)若将此实验改为中和滴定实验应用 作为指示剂。
(4)随着NaOH的加入,水的电离受到一定的影响,当水的电离达到最大时溶液中的溶质为 。
(5)当测得pH为7时共用去V(NaOH)=VmL,请用V的表达式表示此时CH3COOH的电离平衡常数。
【答案】(14分)
(1)a点的溶质为CH3COOH。b点的溶质为CH3COOH和CH3COONa,c点的溶质为CH3COOH和CH3COONa,d点的溶质为CH3COOH和CH3COONa或CH3COONa或CH3COONa和NaOH。(4分)
(2)pH>7;弱酸;(各1分)200.0mL(2分)
(3)酚酞(1分)
(4)CH3COONa(2分)
(5)K=10-9V/(2-10-2V) (3分)
【解析】
试题分析:
(1)常温下,向20.0mL,0.1mol/LCH3COOH溶液中逐滴加入0.01mol/L的NaOH溶液,a点没有滴入NaOH溶液,其溶质为CH3COOH;b点呈酸性,则溶质为CH3COOH、CH3COONa;c点溶液的pH=7,溶质为CH3COOH和CH3COONa;d点溶液呈碱性,溶质可能为CH3COOH和CH3COONa或CH3COONa或CH3COONa和NaOH,故答案为:CH3COOH、CH3COOH和CH3COONa、CH3COOH和CH3COONa、CH3COOH和CH3COONa或CH3COONa或CH3COONa和NaOH;
(2)CH3COOH与NaOH恰好完全反应生成CH3COONa,醋酸根离子部分水解,溶液显示碱性,所以此时溶液的pHpH>7;根据盐的水解原理可知强碱弱酸盐溶液显示碱性,由此实验可验证CH3COOH为弱酸;20.0mL,0.1mol/LCH3COOH溶液中含有醋酸的物质的量为:0.1mol/L×0.02L=0.002mol,则需要0.002molNaOH才能恰好反应,则需要0.01mol/L的氢氧化钠溶液的体积为:![]() =0.2L=200mL,故答案为:pH>7;弱;200;
=0.2L=200mL,故答案为:pH>7;弱;200;
(3)氢氧化钠和醋酸恰好反应时生成醋酸钠,此时溶液呈碱性,酚酞的变色范围为8-10,可以选用酚酞做指示剂,故答案为:酚酞;
(4)酸溶液中的氢离子,碱溶液中的氢氧根离子都抑制了水的电离,而能够水解的盐溶液会促进水的电离,则溶质为CH3COONa时水的电离程度最大,故答案为:CH3COONa;
(5)当测得pH为7时共用去V(NaOH)=VmL,此时溶液中氢离子浓度为:c(H+)=c(OH-)=1×10-7mol/L,根据电荷守恒可知:c(CH3COO-)=c(H+)=![]() =
=![]() mol/L,根据物料守恒可知醋酸的浓度为:0.1mol/l×
mol/L,根据物料守恒可知醋酸的浓度为:0.1mol/l×![]() -
-![]() mol/L=
mol/L=![]() mol/L-
mol/L-![]() mol/L,则醋酸的电离平衡常数K=
mol/L,则醋酸的电离平衡常数K= =
=![]() ×10-7,答:此时CH3COOH的电离平衡常数K=
×10-7,答:此时CH3COOH的电离平衡常数K=![]() ×10-7。
×10-7。