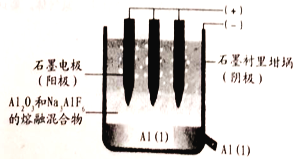
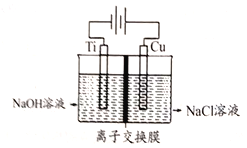
题目内容
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ. 配制50mL1.0mol/LFeBr2溶液;
ⅱ. 上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液常加少量HBr是为了_____________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_____________________。
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上层清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
【答案】 抑制Fe2+的水解 Fe3+ 4Fe2++O2+4H+=4Fe3++2H2O Cl2+2Fe2+=2Cl-+ 2Fe3+ 溶液中含有的Fe3+可与I-反应生成I2使淀粉变蓝 静置后,上层溶液为黄色,下层溶液无色
【解析】(1)①FeBr2溶液中亚铁离子能够水解,加少量HBr可以抑制Fe2+的水解,故答案为:抑制Fe2+的水解;
②FeBr2溶液呈黄色,是因为含有铁离子,因亚铁离子具有还原性,易被空气中的氧气氧化,反应离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O,故答案为:Fe3+;4Fe2++O2+4H+=4Fe3++2H2O;
(2)①Cl2具有强氧化性,可使Fe2+转化为Fe3+,自身被还原生成氯离子,离子方程式为:Cl2+2Fe2+=2C1-+2Fe3+,故答案为:Cl2+2Fe2+=2C1-+2Fe3+;
②铁离子具有氧化性、碘离子具有还原性,溶液中含有的Fe3+可与I-反应,二者发生氧化还原反应生成亚铁离子和碘单质,离子方程式为2Fe3++2I-=2Fe 2++I2,I2使淀粉变蓝,故答案为:溶液中含有的Fe3+可与I-反应生成I2使淀粉变蓝;
③少量Cl2与Fe2+反应,加入CCl4萃取后,静置后,上层溶液为黄色,为铁离子,下层溶液无色,说明不含有溴,因溴单质在四氯化碳中呈现紫色,故答案为:静置后,上层溶液为黄色,下层溶液无色。

 名校课堂系列答案
名校课堂系列答案【题目】(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下。
2P(s)+3Cl2(g)=2PCl3(g) ΔH=-612kJ/mol
2P(s)+5Cl2(g)=2PCl5(g) ΔH=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为________.
(2)不同温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
CO2(g)+H2(g) ΔH1的平衡常数如下表所示。
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
则ΔH1______0(填“<”“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mol/L,则CO的平衡转化率为______。
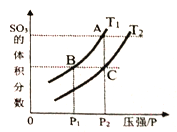
(3)在一定体积的绝热密闭容器中,对于反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
2SO3(g) ΔH<0,判断该反应达到平衡状态的标志是_____________。
A.SO2和SO3浓度相等
B.容器中混合气体的密度保持不变
C.容器中气体的温度保持不变
D.SO3的生成速率与SO2的消耗速率相等
当温度为T1、T2时,平衡体系SO3的体积分数随压强变化曲线如上图所示。则T1____T2 (填“>”或“<");理由是_____。如果想加快正反应的速率,除了改变温度,还可以用_______方法。