��Ŀ����
����Ŀ��̼���仯������������������������ϵ��
��1����֪1g������ȫȼ�������ȶ���������ʱ�ų�Q kJ������,д����ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ��
��2����֪��C(s)��H2O(g)=CO(g)��H2(g) ��H����130 kJ��mol��1,
2C(s)��O2(g)=2CO(g) ��H����220 kJ��mol��1���Ͽ�1 mol H��H����O===O���ֱ���Ҫ����436 kJ��496 kJ����������Ͽ�1 mol O��H����Ҫ���յ�����Ϊ
A��332 kJ B��118 kJ
C��462 kJ D��360 kJ
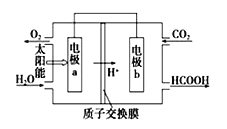
��3����CO2��H2OΪԭ���Ʊ�HCOOH��O2��ԭ���ԭ����ͼ���缫a��b���淢���ĵ缫��Ӧʽ�ֱ�Ϊ��
a�� ��b�� ��
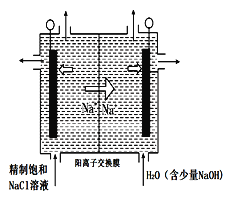
��4��ͼ����ʯī���缫����һ�������µ�ⱥ��ʳ��ˮ��ȡClO2���塣����������ClO2�ĵ缫��ӦʽΪ_______________________����ƽ���ƶ�ԭ������������pH�����ԭ��_____________��
���𰸡���1��CH4(g)+2O2(g)=CO2(g)+2H2O(g)��H=-16QkJ/mol
��2��C��3��a��2H2O-4e-=O2��+4H+b��2CO2+4e-+4H+=2HCOOH
��4��2H2O+Cl--5e-=ClO2��+4H+������������2H����2e��===H2����H��Ũ�ȼ�С��ʹH2O![]() H����OH����ƽ�������ƶ���OH��Ũ��������pH������
H����OH����ƽ�������ƶ���OH��Ũ��������pH������
��������
�����������1����25�桢101kPa�£�1g����ȼ������CO2��Һ̬ˮʱ����QkJ����16g������ȫȼ�����ɶ�����̼��Һ̬ˮ�ų�������Ϊ16QKJ�������ȼ���ȵ��Ȼ�ѧ����ʽΪ��CH4(g)+2O2(g)�TCO2(g)+2H2O(l)��H=-16QKJmol-1��
�ʴ�Ϊ��CH4(g)+2O2(g)�TCO2(g)+2H2O(l)��H=-16QKJmol-1��
��2����֪��C(s)+H2O(g)�TCO(g)+H2(g)��H=+130kJmol-1��
��2C(s)+O2(g)�T2CO(g)��H=-220kJmol-1
�١�2-�ڵã�2H2O(g)�TO2(g)+2H2(g)��H=(2��130+220)kJmol-1=480kJmol-1��
��O-H����ΪakJmol-1����4a-496-2��436=480�����a=462��ѡ��C��ȷ����ѡC��
��3����ͼ��֪�����Ҽ���ˮ�����������������ӣ��缫a���淢��������Ӧ��Ϊ�������缫��ӦʽΪ2H2O-4e-�TO2��+4H+������ͨ�������̼����������������HCOOH���缫b���淢����ԭ��Ӧ��Ϊ�������缫��ӦʽΪ2CO2+4e-+4H+�T2HCOOH��
��4���������֪�������ӷŵ�����ClO2����Ԫ���غ��֪����ˮ�μӷ�Ӧ��ͬʱ���������ӣ��缫��ӦʽΪ��Cl--5e-+2H2O=ClO2��+4H+�����������H+Ũ�ȼ�С��ʹ��H2OOH-+H+��ƽ�������ƶ�����Һ��pH����
�ʴ�Ϊ��2H2O+Cl- -5e-=ClO2��+4H+������������2H����2e��===H2����H��Ũ�ȼ�С��ʹH2O![]() H����OH����ƽ�������ƶ���OH��Ũ������pH����
H����OH����ƽ�������ƶ���OH��Ũ������pH����