题目内容
(1)18g重水2H2O中含氢原子 个,含电子数为 个.(2)在无土栽培中,配制只含0.5mol/LNH4+、0.6mol/L Cl-、0.5mol/L K+、 mol/L SO42-的某营养液,若用KCl、(NH4)2 SO4、 配制1L该营养液,则需这三种固体的物质的量分别为 0.5mol、0.2mol、 mol.
【答案】分析:(1)根据n=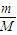 计算18g重水2H2O的物质的量,由化学式2H2O可知,H原子物质的量是水分子的2倍,根据N=nNA计算H原子数目;
计算18g重水2H2O的物质的量,由化学式2H2O可知,H原子物质的量是水分子的2倍,根据N=nNA计算H原子数目;
每个2H2O分子含有10个电子,电子物质的量是水分子的10倍,根据N=nNA计算电子数目;
(2)根据溶液中电荷守恒可知,溶液中c(NH4+)+c(K+)=c(Cl-)+2c(SO42-),据此计算SO42-的浓度;
根据n=cV计算溶液中NH4+、Cl-、K+、SO42-的物质的量,计算0.5molKCl、0.2mol(NH4)2 SO4中含有的NH4+、Cl-、K+、SO42-的物质的量,据此确定缺少的离子及物质的量,进而确定还需要的物质及物质的量.
解答:解:(1)18g重水2H2O的物质的量为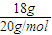 =0.9mol,由化学式2H2O可知,n(H)=0.9mol×2=1.8mol,故含有H原子数目为1.8mol×NAmol-1=1.8NA;
=0.9mol,由化学式2H2O可知,n(H)=0.9mol×2=1.8mol,故含有H原子数目为1.8mol×NAmol-1=1.8NA;
每个2H2O分子含有10个电子,电子物质的量是水分子的10倍,故n(电子)=0.9mol×10=9mol,故含有电子数目为9mol×NAmol-1=9NA,
故答案为:1.8NA,9NA;
(2)根据溶液中电荷守恒可知,溶液中c(NH4+)+c(K+)=c(Cl-)+2c(SO42-),所以0.5mol/L+0.5mol/L=0.6mol/L+2c(SO42-),故c(SO42-)=0.2mol/L;
1L溶液中n(NH4+)=1L×0.5mol/L=0.5mol,n(Cl-)=1L×0.6mol/L=0.6mol,n(K+)=1L×0.5mol/L=0.5mol,n(SO42-)=1L×0.2mol/L=0.2mol.0.5molKCl中含有n′(K+)=0.5mol,n′(Cl-)=0.5mol,0.2mol(NH4)2 SO4中含有的n′(NH4+)=0.4mol,n′(SO42-)=0.2mol,故还缺少0.1molNH4+、0.1molCl-,故还需要0.1molNH4Cl,
故答案为:0.2,NH4Cl,0.1.
点评:考查常用化学计量的有关计算、物质中原子数目的计算等,难度中等,注意利用电荷守恒计算混合溶液中离子浓度.
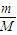 计算18g重水2H2O的物质的量,由化学式2H2O可知,H原子物质的量是水分子的2倍,根据N=nNA计算H原子数目;
计算18g重水2H2O的物质的量,由化学式2H2O可知,H原子物质的量是水分子的2倍,根据N=nNA计算H原子数目;每个2H2O分子含有10个电子,电子物质的量是水分子的10倍,根据N=nNA计算电子数目;
(2)根据溶液中电荷守恒可知,溶液中c(NH4+)+c(K+)=c(Cl-)+2c(SO42-),据此计算SO42-的浓度;
根据n=cV计算溶液中NH4+、Cl-、K+、SO42-的物质的量,计算0.5molKCl、0.2mol(NH4)2 SO4中含有的NH4+、Cl-、K+、SO42-的物质的量,据此确定缺少的离子及物质的量,进而确定还需要的物质及物质的量.
解答:解:(1)18g重水2H2O的物质的量为
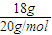 =0.9mol,由化学式2H2O可知,n(H)=0.9mol×2=1.8mol,故含有H原子数目为1.8mol×NAmol-1=1.8NA;
=0.9mol,由化学式2H2O可知,n(H)=0.9mol×2=1.8mol,故含有H原子数目为1.8mol×NAmol-1=1.8NA;每个2H2O分子含有10个电子,电子物质的量是水分子的10倍,故n(电子)=0.9mol×10=9mol,故含有电子数目为9mol×NAmol-1=9NA,
故答案为:1.8NA,9NA;
(2)根据溶液中电荷守恒可知,溶液中c(NH4+)+c(K+)=c(Cl-)+2c(SO42-),所以0.5mol/L+0.5mol/L=0.6mol/L+2c(SO42-),故c(SO42-)=0.2mol/L;
1L溶液中n(NH4+)=1L×0.5mol/L=0.5mol,n(Cl-)=1L×0.6mol/L=0.6mol,n(K+)=1L×0.5mol/L=0.5mol,n(SO42-)=1L×0.2mol/L=0.2mol.0.5molKCl中含有n′(K+)=0.5mol,n′(Cl-)=0.5mol,0.2mol(NH4)2 SO4中含有的n′(NH4+)=0.4mol,n′(SO42-)=0.2mol,故还缺少0.1molNH4+、0.1molCl-,故还需要0.1molNH4Cl,
故答案为:0.2,NH4Cl,0.1.
点评:考查常用化学计量的有关计算、物质中原子数目的计算等,难度中等,注意利用电荷守恒计算混合溶液中离子浓度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目