题目内容
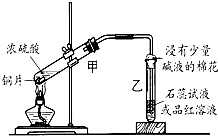
 浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.
浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.
(1)若试管乙中装的是石蕊试液,则反应过程中观察到乙中的现象是______;若试管乙中装的是品红溶液,则反应过程中观察到乙中的现象是______.
(2)反应结束后在试管甲的底部常可见到一些白色固体,该固体可能是______ (填化学式).待试管甲内液体冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察溶液的颜色.这一步操作的目的是要证实______.
(3)写出上述试管甲中发生反应的化学方程式______,若收集到标准状况下气体0.56L,则反应中转移电子的物质的量为______.
 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,(1)二氧化硫为酸性气体,与水反应生成H2SO3,溶液呈酸性,可使石蕊试液变红,具有漂白性,可使品红褪色,
故答案为:石蕊试液变红;品红溶液褪色;
(2)反应生成CuSO4,为白色固体,溶于水溶液呈蓝色,为Cu2+的颜色,故答案为:CuSO4;溶液中有Cu2+存在;
(3)反应的化学方程式为Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O,n(SO2)=
CuSO4+SO2↑+2H2O,n(SO2)=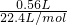 =0.025mol,
=0.025mol,则转移的电子的物质的量为2×0.025mol=0.05mol,
故答案为:0.05mol.
分析:在加热条件下铜与浓硫酸发生:Cu+2H2SO4(浓)
 CuSO4+SO2↑+2H2O,
CuSO4+SO2↑+2H2O,(1)二氧化硫为酸性气体,可使石蕊试液变红,具有漂白性,可使品红褪色;
(2)白色固体为CuSO4,溶于水溶液呈蓝色;
(3)根据反应的化学方程式计算转移电子的物质的量.
点评:本题考查硫酸与铜反应的知识,题目难度不大,注意该反应的化学方程式,为解答该题的重要问题,注意从化合价的变化的角度计算电子的物质的量.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g 铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)

(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
A.铁粉 ?????? B.钠 ???? ?? C.氯化钡溶液 ???????? D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
方案① |
|
|
|
方案② |
|
|
|
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
 浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.
浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.